
铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况
下体积相等时,反应中消耗的盐酸和氢氧化钠物质的量之比为
A.3:1 B.2:1 C.1:1 D,1:3
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
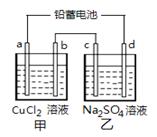
用铅蓄电池电解甲、乙电解池中的溶液。 电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
A.d极为阴极 B.若利用甲池精炼铜,b极应为粗铜
C.放电时铅蓄电池负极的电极反应式为:
PbO2(s) + 4 H+(aq)+SO4 2-(aq)+4e- = PbSO4 (s) +2H2O (l)
D.若四个电极材料均为石墨,当析出6.4 g Cu时,两池中共产生气体3.36 L(标准状况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
铜粉加入稀盐酸中,加热无现象,这时加入一种盐则铜粉溶解而溶液变蓝,同时有气体放出,这种盐是
A.NaCI B.KNO3 C.FeCl2 D.Fe2(SO4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
人民网西昌报道组2013年10月1日电:约19时26分,嫦娥二号宣布成功发射。据早些时候报道,昨天上午9时起,工作人员开始为“嫦娥二号”和长三丙火箭加注常规燃料,至14时30分左右加注的是燃烧剂;此后至18时左右加注氧化剂。
已知:A、B、C、D是元素周期表中的四种短周期元素,且原子序数依次增大,A的单质是上述资料中的“燃烧剂”,C的单质是上述资料中的“氧化剂”;A元素原子中没有中子; 与
与 两种元素存在关系:b=c-l;C元素常见化合价的绝对值与其所在周期数相同,且B、C能形成多种气态化合物,其中一种可以在大自然状态下形成;A、D两种元素形成的双原子分子的水溶液是工业三大强酸之一。请解答下列问题:
两种元素存在关系:b=c-l;C元素常见化合价的绝对值与其所在周期数相同,且B、C能形成多种气态化合物,其中一种可以在大自然状态下形成;A、D两种元素形成的双原子分子的水溶液是工业三大强酸之一。请解答下列问题:
(1)A元素在元素周期表第________族中,D元素在元素周期表第________周期中。
(2)B原子的原子结构示意图为________。
(3)A、B两种元素形成的四原子分子的电子式为________。
(4)A的单质与C的单质发生反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是 ( )。
A.丙烯的结构简式为CH2CHCH3
B.2,2-二甲基丙烷的一氯代物有2种
C.分子式为CH4O和C2H6O的物质一定互为同系物
D.键线式为 的有机物的分子式为C8H8
的有机物的分子式为C8H8
查看答案和解析>>
科目:高中化学 来源: 题型:
利胆解痉药“亮菌甲素”跟(CH3)2SO4反应可以生成A,二者的结构简式如下图。
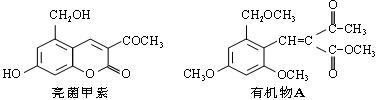
N 试回答下列有关问题:
(1)“亮菌甲素”的分子式为_______;1 mol“亮菌甲素”跟浓溴水反应时最多消耗_____ mol Br2。
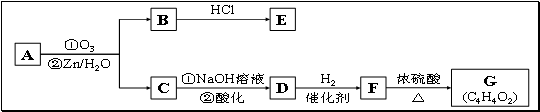
(2)有机物A能发生如下转化。其中G分子中的碳原子在一条直线上。
已知:⑴  C=C
C=C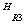

 C=O + O= C
C=O + O= C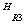
⑵R−O−CH3 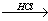 R−OH(R为脂肪烃或芳香烃的烃基)
R−OH(R为脂肪烃或芳香烃的烃基)
① C→D的化学方程式是_________________________________________________________;
②G的结构简式是 ;
③同时符合下列条件的E的同分异构体有 种:
a.遇FeCl3溶液显色;
b.不能发生水解反应,能发生银镜反应;
c.苯环上的一氯取代物只有一种,分子中无甲基
写出其中至少2种的结构简式:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车在现代生活中扮演着越来越重要的角色,但其尾气(碳氢化合物、氮氧化物及一氧化碳等)带来的环境污染越来越明显,机动车废气排放已成为城市大气污染的重要来源。
(1)设汽油成分为C8H18,若在气缸中汽油高温裂解产生丁烷和丁烯,写出该反应的化学方程
▲ 。
(2)气缸中生成NO的反应为:N2(g)+O2(g)  2NO(g) △H >0
2NO(g) △H >0
①汽车启动后,气缸内温度越高,单位时间内NO排放量越大,原因是 ▲ 。
②1mol空气中含有0.8molN2和0.2molO2,1300℃时在含1mol空气的密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K≈ ▲ 。
(3)尾气中的CO主要来自于汽油不完全燃烧。
①有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g) △H=+221kJ·mol-1,简述该设想能否实现的依据: ▲ 。
②测量汽车尾气的浓度常用电化学气敏传感器,其中CO传感器可用下图简单表示,则阳极发生的电极反应为 ▲ 。
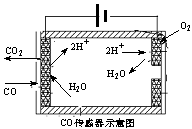
(4)在汽车尾气系统中安装催化转换器,可有效减少尾气中的CO、NOx 和碳氢化合物等废气。
已知:N2(g)+O2(g)=2NO(g) △H1=+180kJ/mol
CO(g) +1/2O2(g)= CO2(g) △H2=-283kJ/mol
2NO(g)+ 2CO(g) = 2CO2(g) + N2(g) △H3
则△H3 = ▲ kJ·mol-1。
(5)光化学烟雾(含臭氧、醛类、过氧乙酰硝酸酯等)是汽车尾气在紫外线作用下发生光化学反应生成的二次污染物。写出2-丁烯与臭氧按物质的量之比为1:2反应生成乙醛及氧气的化学方程式 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com