
| Wg×1mol |
| 46g |
| W |
| 46 |
| Wg×1mol |
| 56g |
| W |
| 56 |
| Wg×3mol |
| 54g |
| W |
| 18 |
| W |
| 46 |
| W |
| 56 |
| W |
| 18 |
| 1 |
| 23 |
| W |
| 28 |
| 1 |
| 9 |
| 1 |
| 23 |
| W |
| 28 |
| 1 |
| 9 |


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,1mol氮气含有NA个氮分子 |
| B、标准状况下,22.4LNO和11.2L氧气混合,气体的分子总数约为1.5NA个 |
| C、常温下,18g重水所含中子数为10NA个 |
| D、31g白磷分子中,含有的共价单键数目是NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化合物 | 甲 | 乙 | 丙 | 丁 | 戊 | 己 |
| 化学式 | A2C | A2C2 | A2B2 | D2C2 | A2E | DF |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠在Cl2中燃烧产生白烟,这是因为产生的NaCl固体颗粒分散到空气中所致 | ||||||||||||
| B、把烧红的铁丝放在放在氧气中,发出耀眼白光,产生黑色固体,这是因为该反应放热多,生成的Fe3O4为黑色 | ||||||||||||
| C、单质Mg、Al与O2反应,条件不同,可能产生不同的产物 | ||||||||||||
D、镁带在空气中点燃发出耀眼光芒,并发生三个反应:2Mg+O2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
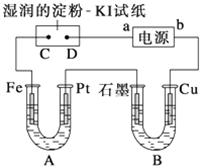 电解装置如图所示.图中B装置盛1L 2mol?L-1的Na2SO4溶液,A装置中盛1L 2mol?L-1AgNO3溶液.通电后,湿润的淀粉KI试纸的C端变蓝色.电解一段时间后,试回答:
电解装置如图所示.图中B装置盛1L 2mol?L-1的Na2SO4溶液,A装置中盛1L 2mol?L-1AgNO3溶液.通电后,湿润的淀粉KI试纸的C端变蓝色.电解一段时间后,试回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com