
 (1)求原混合物中Na2CO3的质量分数。
(1)求原混合物中Na2CO3的质量分数。 (1)解:设混合物中Na2CO3和NaHCO3的物质的量分别为x、y ,
则由题意可得:106x+84y=14.8g
2x+y=0.100L×2.50mol?L-1=0.250mol ………1分
解之得:x=0.100mol,y=0.0500mol ………1分
![]() ………1分
………1分
(2)解:V[HCl(aq)]=![]() …… …2分
…… …2分
(3)由于恰好完全反应需100mL 2.50mol?L-1的盐酸,故加90mL时,盐酸不足
Na2CO3+HCl=NaHCO3+NaCl NaHCO3+HCl=NaCl+H2O+CO2↑
0.100mol 0.100mol ………1分
与NaHCO3反应的盐酸0.090L×2.50mol?L-1-0.100mol=0.125mol ………1分
V(CO2)=0.125moL×22.4L?mol-1=2.80L ………1分


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:阅读理解
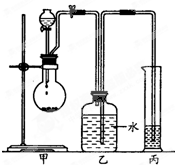 某化学小组探究液体有机物样品A(C3H8O2)的结构,进行如下实验.
某化学小组探究液体有机物样品A(C3H8O2)的结构,进行如下实验.| 实验编号 | 有机样品的体积 | 有机样品的质量 | 生成气体的体积(标准状况下) | I | 3.65mL | 3.8g | 1120mL | II | 7.30mL | 7.6g | 2240mL | III | 14.60mL | 15.2g | 4000mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
称取27.6g白云石(化学式为xCaCO3·yMgCO3),加热到质量不再变化时,收集到6.72L(标准状况)CO2。下列有关说法正确的是( )
A.x=2,y=1 B.残留固体的质量为14.4g
C.13.8g该白云石与足量盐酸反应,最多收集到标准状况下2.24L的CO2
D.9.2g白云石与2.0mol/L盐酸充分反应,消耗盐酸的体积为50mL
查看答案和解析>>
科目:高中化学 来源: 题型:
白云石的化学式是xCaCO3?yMgCO3。可用于制取耐火材料等,优质的白云石粉可作为昂贵的二氧化钛填料的替代品。现称取27.6g白云石,加热到质量不再变化,收集到的CO2为6.72L(已换算成标准状况)。下列有关说法正确的是
A.白云石的化学式为2CaCO3?MgCO3
B.残留固体的质量为14.4g
C.取13.8g该白云石与足量盐酸完全反应,最多收集到标准状况下的CO22.24L
D.27.6g白云石与过量盐酸完全反应,可消耗HCl0.3mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com