
| A. | 电解硫酸时,阴极产生1molH2时,阳极一定产生0.5molO2 | |
| B. | 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5mol | |
| C. | 电解1mol熔融的Al2O3,能产生33.6L氧气、54.0g金属铝 | |
| D. | 工业用电解法进行粗铜精炼时,每转移1mol电子,阳极上就溶解0.5NA个铜原子 |
分析 A.电解硫酸时,若为惰性电极阴极生成氢气,阳极生成氧气,且由转移电子可计算生成气体的物质的量;
B.结合n=$\frac{N}{{N}_{A}}$及分子构成计算;
C.发生2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑,由V=nVm、m=nM计算,但气体状况未知;
D.工业用电解法进行粗铜精炼时,比Cu活泼的金属先失去电子.
解答 解:A.电极材料未知,阳极不一定生成气体,且转移电子未知,不能计算生成气体的物质的量,故A错误;
B.盛有SO2的密闭容器中含有NA个氧原子,n(O)=1mol=2n(SO2),则SO2的物质的量为0.5mol,故B正确;
C.发生2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑,则电解1mol熔融的Al2O3,能产生1.5mol氧气、2molAl,即54.0g金属铝,但气体状况未知,不能计算氧气的体积,故C错误;
D.工业用电解法进行粗铜精炼时,比Cu活泼的金属先失去电子,则每转移1mol电子,阳极上溶解少于0.5NA个铜原子,阴极上就生成0.5NA个铜原子,故D错误;
故选B.
点评 本题考查化学反应方程式的计算,为高频考点,把握电解原理、电解反应及物质的量的计算为解答的关键,侧重分析与计算能力的考查,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸保存在玻璃试剂瓶中 | B. | 氯水保存在棕色试剂瓶中 | ||
| C. | 金属钠保存在无水酒精中 | D. | 浓硝酸保存在无色试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 反应类型为氧化反应.
反应类型为氧化反应. )的核磁共振氢谱有1个信号峰,试写出与其互为同分异构体且核磁共振氢谱有
)的核磁共振氢谱有1个信号峰,试写出与其互为同分异构体且核磁共振氢谱有 )为原料可以合成聚酯PTT,写出其化学方程式
)为原料可以合成聚酯PTT,写出其化学方程式 .
.
 ,请你设计出合理的反应流程图
,请你设计出合理的反应流程图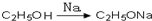 、
、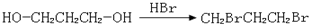 、
、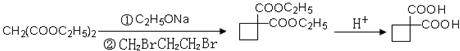 .提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:A$→_{反应条件}^{反应物}$ B$→_{反应条件}^{反应物}$ C …
.提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:A$→_{反应条件}^{反应物}$ B$→_{反应条件}^{反应物}$ C …查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (3a+b)mol | B. | (3a+$\frac{b}{2}$)mol | C. | (3a+3p+$\frac{b}{2}$)mol | D. | (3a+$\frac{b}{2}$-3p)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 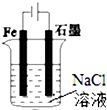 图①两极均有气泡产生,滴加酚酞溶液时石墨一极变红 | |
| B. | 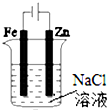 图②装置可以验证牺牲阳极的阴极保护法 | |
| C. |  图③可以模拟钢铁的吸氧腐蚀,铁棒一极的电极反应式:Fe=Fe 2++2e- | |
| D. | 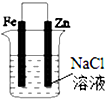 分别给上述4个装置的铁电极附近滴加少量K3[Fe(CN)6]溶液,②④出现蓝色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 物,写出该化学反应方程式CH3CH2OH+CH2=CH2$\stackrel{一定条件下}{→}$CH3CH2OCH2CH3.
物,写出该化学反应方程式CH3CH2OH+CH2=CH2$\stackrel{一定条件下}{→}$CH3CH2OCH2CH3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
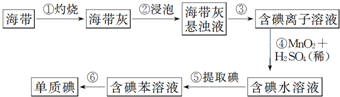
| A. | 步骤①需要用到蒸发皿 | B. | 步骤③需要过滤装置 | ||
| C. | 步骤⑤需要用到分液漏斗 | D. | 步骤⑥需要蒸馏装置 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com