
| A. | 称量样品→加热→冷却→称量CuO | |
| B. | 称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量 | |
| C. | 称量样品→加热→冷却→称量Cu(NO3)2 | |
| D. | 称量样品→加NaOH→过滤→加热→冷却→称量CuO |
分析 测定Cu(NO3)2•nH2O里结晶水的含量,实验步骤为:①研磨、②称量空坩埚和装有试样的坩埚的质量、③加热、④冷却、⑤称量、⑥重复③至⑤的操作,直到连续两次称量的质量差不超过0.001g为止 ⑦根据实验数据计算硝酸铜结晶水的含量,注意硝酸铜受热分解产物为氧化铜.
解答 解:Cu(NO3)2•nH2O受热易分解,其分解反应为:2 Cu(NO3)2•nH2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑+2nH2O,
A.称量样品→加热→冷却→称量CuO,根据Cu原子守恒及m(CuO)可测定Cu(NO3)2•nH2O的结晶水含量,故A不选;
B.称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量,根据水的质量以及结晶水合物的质量可以求解,故B不选;
C.因硝酸铜易分解,称量样品→加热无法恰好使结晶水合物恰好分解为硝酸铜,故C选;
D.称量样品→加NaOH将Cu(NO3)2转化为Cu(OH)2,然后过滤→加热Cu(OH)2分解生成CuO,冷却→称量CuO,根据Cu守恒求解m[Cu(NO3)2],据此求解结晶水含量,故D不选;
故选C.
点评 本题以硝酸铜结晶水测定为载体考查化学实验评价,为高频考点,侧重考查学生实验操作、实验分析评价能力,明确实验原理及物质性质是解本题关键,注意C中加热Cu(NO3)2时,Cu(NO3)2易分解生成CuO,为易错点.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1820 | 2750 | 11600 |
| A. | 元素X的常见化合价是+3 | |
| B. | 元素Y是ⅢA族元素 | |
| C. | 元素X与氯元素形成化合物时,化学式可能是XCl2 | |
| D. | 若元素Y处于第三周期,它可与冷水剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 坩埚质量(g) | 坩埚和晶体的总质量(g) | 加热后坩埚和剩余固体的质量(g) |
| 11.685 | 13.691 | 12.948 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、NO2或CO2的大量排放都会导致酸雨的形成 | |
| B. | 氟氯烃等化合物的大量排放会破坏大气臭氧层 | |
| C. | 重金属、有机农药和工业废水的任意排放等会造成水体污染 | |
| D. | 装饰材料中的甲醛、苯和放射性元素氡等会造成居室污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能(KJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15399 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
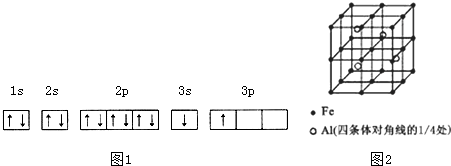
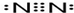 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
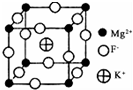 卤族元素是典型的非金属元素,单质及其化合物在工农业生产和生活中有重要的用途.
卤族元素是典型的非金属元素,单质及其化合物在工农业生产和生活中有重要的用途. 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
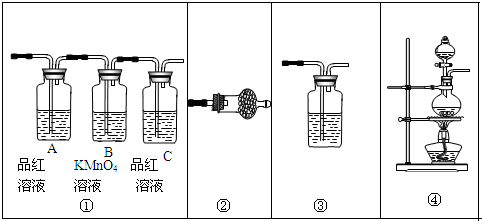
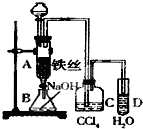 某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量氨水:Al3++4NH•H2O═AlO2-+4NH4++2H2O | |
| B. | 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3+3H+ | |
| C. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com