
| A�� | ��Ӧ�����У�����Сѹǿ�����SiCl4��ת���� | |
| B�� | ����Ӧ��ʼʱSiCl4Ϊ1mol�����ƽ��ʱ����������ΪQkJ | |
| C�� | ��Ӧ��4minʱ����HClŨ��Ϊ0.12mol/L����H2�ķ�Ӧ����Ϊ0.03mol/��L•min�� | |
| D�� | ����Ӧ��������Ϊ0.5QkJʱ�����ɵ�HClͨ��1L 1mol/L��NaOH��Һǡ����ȫ��Ӧ |
���� A���ӷ���ʽ���Կ�������Ӧ������ļ�����֮��С������������ļ�����֮�ͣ����Сѹǿ��ƽ��������Ӧ����
B���÷�ӦΪ���淴Ӧ��1molSiCl4������ȫת����
C����Ӧ��4minʱ����HClŨ��Ϊ0.12mol/L����v��HCl��=$\frac{0.12mol/L}{4min}$=0.03mol/��L•min�������ݷ�Ӧ����֮�ȵ��ڻ�ѧ������֮�ȼ��㣻
D���ɷ���ʽ��֪������Ӧ��������Ϊ0.5QkJʱ������HCl�����ʵ���Ϊ��$\frac{0.5QKJ��4mol}{QKJ}$=2mol��1L1mol/L��NaOH�����ʵ���Ϊ1L��1mol/L=1mol�����߷�Ӧ��ʣ��HCl��8
��� �⣺��ҵ���Ʊ����跴Ӧ���Ȼ�ѧ����ʽ���£�SiCl4��g��+2H2��g���TSi��s��+4HCl��g������H=+QkJ•mol-1��Q��0����ij�¶ȡ�ѹǿ�£���һ�����ķ�Ӧ��ͨ���ܱ������������ϵķ�Ӧ����������Ϊ���淴Ӧ����
A����Ӧ�����У�����Сѹǿ��ƽ��������Ӧ�����ƶ���SiCl4��ת��������A��ȷ��
B������Ӧ��ʼʱSiCl4Ϊ1mol����Ϊ���淴Ӧ����ﵽƽ��ʱ����Ӧ��SiCl4ӦС��1mol������������ӦС��QkJ����B����
C��SiCl4��g��+2H2��g���TSi��s��+4HCl��g������H=+QkJ•mol-1��Q��0��
0.06mol•L-1 0.12mol•L-1
��Ӧ��4minʱ����HCl��Ũ��Ϊ0.12mol•L-1����Ӧ��H2��Ũ��Ϊ��0.06mol•L-1�������ķ�Ӧ����V��H2��=$\frac{0.06mol/L}{4min}$=0.015mol/��L•min������C����
D��SiCl4��g��+2H2��g���TSi��s��+4HCl��g������H=+QkJ•mol-1��Q��0��
4mol QkJ
2 mol 0.5QkJ
����Ӧ��������Ϊ0.5QkJʱ�����ɵ�HClΪ2mol��ͨ��1L1mol•L-1��NaOH��Ӧ��HClʣ�࣬��D����
��ѡA��
���� ���⿼���Ϊ�ۺϣ��漰��Ӧ�ȵļ��㡢��ѧ��Ӧ���ʡ���ѧƽ������⣬��Ŀ�Ѷ��еȣ�ע�ⷴӦ�Ŀ����ԣ�


 ������ȫ��������ϵ�д�
������ȫ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Mg2+�Ľṹʾ��ͼ��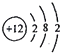 | |
| B�� | ����Ľṹ��ʽ��CH3CH2OH | |
| C�� | ����صĵ��뷽��ʽ��K2SO4�TK2++SO${\;}_{4}^{2-}$ | |
| D�� | CO2�ĵ���ʽ��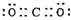 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| t/min | 0 | 20 | 40 | 60 | 80 |
| c��H2O2��/mol•L-1 | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����CO | B�� | �NaHSO4 | C�� | ����� | D�� | ��Σ�NH3•H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ʯ�ͷ����õ������͡����͡�ú�͵ȶ��Ǵ����� | |
| B�� | ���������������ȼú����������β����������������߿������� | |
| C�� | ̫���ܵ�ذ��еĹ�Ԫ����Ԫ�����ڱ��д��ڽ�����ǽ����Ľ���λ�� | |
| D�� | ú����������Һ�����������仯���ɱ�Ϊ�����Դ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڶ����ڢ�A�� | B�� | ��������IA�� | C�� | �������ڢ�A�� | D�� | �ڶ����ڢ�A�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ռ���Һ��С�մ���Һ��Ӧ��OH-+HCO3-�TH2O+CO2�� | |
| B�� | ̼������ڴ��CaCO3+2H+�TCa2++H2O+CO2 | |
| C�� | �Ȼ����������ˮ��Al3++4OH-�TAlO2-+2H2O | |
| D�� | ������������������1��1��Ӧ��SO42-+H++Ba2++OH-�TBaSO4��+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ۢ� | B�� | �ڢܢ� | C�� | ֻ�Т� | D�� | ֻ�Т� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com