
在制取下列气体过程有氧化还原反应的是
[ ]
①用浓硫酸和固体NaCl制HCl②用KClO3和MnO2混合加热制取O2
③固体NH4Cl和Ca(OH)2 共热制取NH3④浓H2SO4和C2H5OH混合加热至170℃
⑤铁粉和稀H2SO4混合制H2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
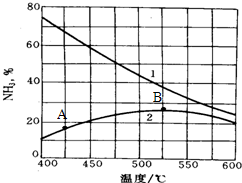
查看答案和解析>>
科目:高中化学 来源: 题型:
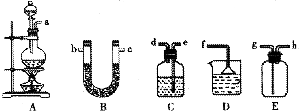
查看答案和解析>>
科目:高中化学 来源: 题型:
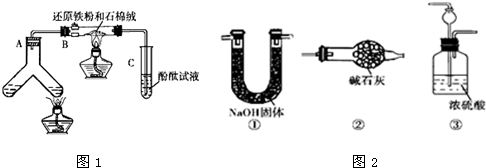
| N2和H2的体积比 | 5:1 | 3:1 | 1:1 | 1:3 | 1:5 |
| 酚酞变红色所需时间/min | 8~9 | 7~8 | 6~7 | 3~4 | 9~10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
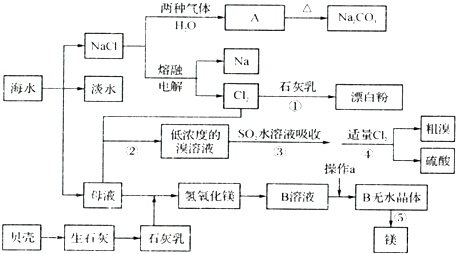
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com