
 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
�� ��
�� ��
��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ˮ������Ϊһ����Ҫ�ľ�ϸ����ԭ�ϣ���ũҩ��ҽҩ���л��ϳ����й㷺��;�� �����ط��Ʊ�ˮ���£��ɷ�Ϊ�����Σ���һ��Ϊ�����Ȼ��Σ��ڶ���Ϊ����ˮ��Σ��ܷ�Ӧ����ʽΪ����NH2��2CO+NaClO+2NaOH��H2N-NH2?H2O+NaCl+Na2CO3��
ˮ������Ϊһ����Ҫ�ľ�ϸ����ԭ�ϣ���ũҩ��ҽҩ���л��ϳ����й㷺��;�� �����ط��Ʊ�ˮ���£��ɷ�Ϊ�����Σ���һ��Ϊ�����Ȼ��Σ��ڶ���Ϊ����ˮ��Σ��ܷ�Ӧ����ʽΪ����NH2��2CO+NaClO+2NaOH��H2N-NH2?H2O+NaCl+Na2CO3���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013�콭��ʡ�Ͼ�ѧ�����ר��ѧУ����4���¿���ѧ�Ծ����������� ���ͣ�ʵ����
ˮ������Ϊһ����Ҫ�ľ�ϸ����ԭ�ϣ���ũҩ��ҽҩ���л��ϳ����й㷺��;�������ط��Ʊ�ˮ���£��ɷ�Ϊ�����Σ���һ��Ϊ�����Ȼ��Σ��ڶ���Ϊ����ˮ��Σ��ܷ�Ӧ����ʽΪ��(NH2)2CO +NaClO+2NaOH �� H2N��NH2·H2O+NaCl+Na2CO3��
��Ҫ����Ӧ��N2H4+2NaClO= N2��+2H2O+2NaCl ��H<0
3NaClO=" 2NaCl" +NaClO3 ��H>0
CO(NH2)2 ��2NaOH= 2NH3��+Na2CO3 ��H>0
�������������(NH2)2CO+3NaClO= N2��+3NaCl+CO2��+2H2O ��H<0
ʵ�鲽�裺
����1����30%��NaOH��Һ��ͨ��Cl2�������¶���30�����£�����Һ��dz����ɫֹͣͨCl2��
����2�����ú�ȡ�ϲ���Һ�����NaClO��Ũ�ȡ�
����3������ϲ���Һ����������Ũ�ȵ�NaClO��NaOH�Ļ����Һ��
����4����ȡһ���������������Һ�����ڱ�ˮԡ����һ���������3��õ���Һ�����Һ©���У������μӵ�������Һ�У�0.5h���ҵ����������0.5h��
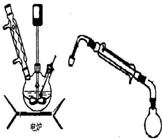
����5��������4������Һ������5g KMnO4��������ת�Ƶ�������ƿ��װ�ü�ͼ�����߽���������£���108�����5 min��
����6���������ܻ��������ܣ������ռ�( 108~114��)��֣��ò�Ʒ��
(1)����1�¶���Ҫ��30�����£�����ҪĿ���� ��
(2)����2���NaClOŨ�ȵ�Ŀ���� ��
a��ȷ������3����NaClO��Һ�����NaOH����
b��ȷ������4�б�ˮԡ���¶ȷ�Χ
c��ȷ������4�г������ص���������ȡ����������Һ�����ϵ
d��ȷ������5����Ļ���ʱ��
(3)���ط��Ʊ�ˮ���£���һ��Ϊ��Ӧ ��ѡ������ȡ������ȡ�����
(4)����5���뼱�����£��ϸ���ƻ���ʱ�䣬��Ŀ���� ��
(5)��֪ˮ�����ڼ��������¾��л�ԭ�ԣ��磺N2H4+2I2=N2+4HI�����ⶨˮ���µ����������ɲ������в��裺
a��ȷ��ȡ2.000g���������ܽ⡢ת�ơ����ݵȲ��裬����250mL��Һ��
b����ȡl0.00 mL����ƿ�У�����20mLˮ��ҡ�ȣ�
c����0.l000 mol/L����Һ�ζ�����Һ������ɫ��Imin�ڲ���ʧ����¼���ĵ�ı�Һ�������
d����һ�����������ݴ���
�ٵζ�ʱ����ı���Һʢ���� �ζ����У�ѡ�����ʽ����ʽ������
�������εζ����ĵ�ı���ҺΪ18.00mL���ɲ������Ʒ��N2H4-H2O����������Ϊ ��
��Ϊ��ø��ɿ��ĵζ����������d�н�һ��������Ҫ�ǣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�꽭��ʡ����4���¿���ѧ�Ծ��������棩 ���ͣ�ʵ����
ˮ������Ϊһ����Ҫ�ľ�ϸ����ԭ�ϣ���ũҩ��ҽҩ���л��ϳ����й㷺��;�������ط��Ʊ�ˮ���£��ɷ�Ϊ�����Σ���һ��Ϊ�����Ȼ��Σ��ڶ���Ϊ����ˮ��Σ��ܷ�Ӧ����ʽΪ��(NH2)2CO +NaClO+2NaOH �� H2N��NH2��H2O+NaCl+Na2CO3��
��Ҫ����Ӧ��N2H4+2NaClO= N2��+2H2O+2NaCl ��H<0
3NaClO=" 2NaCl" +NaClO3 ��H>0
CO(NH2)2 ��2NaOH= 2NH3��+Na2CO3 ��H>0
�������������(NH2)2CO+3NaClO= N2��+3NaCl+CO2��+2H2O ��H<0
ʵ�鲽�裺
����1����30%��NaOH��Һ��ͨ��Cl2�������¶���30�����£�����Һ��dz����ɫֹͣͨCl2��
����2�����ú�ȡ�ϲ���Һ�����NaClO��Ũ�ȡ�
����3������ϲ���Һ����������Ũ�ȵ�NaClO��NaOH�Ļ����Һ��
����4����ȡһ���������������Һ�����ڱ�ˮԡ����һ���������3��õ���Һ�����Һ©���У������μӵ�������Һ�У�0.5h���ҵ����������0.5h��
����5��������4������Һ������5g KMnO4��������ת�Ƶ�������ƿ��װ�ü�ͼ�����߽���������£���108�����5 min��

����6���������ܻ��������ܣ������ռ�( 108~114��)��֣��ò�Ʒ��
(1)����1�¶���Ҫ��30�����£�����ҪĿ���� ��
(2)����2���NaClOŨ�ȵ�Ŀ���� ��
a��ȷ������3����NaClO��Һ�����NaOH����
b��ȷ������4�б�ˮԡ���¶ȷ�Χ
c��ȷ������4�г������ص���������ȡ����������Һ�����ϵ
d��ȷ������5����Ļ���ʱ��
(3)���ط��Ʊ�ˮ���£���һ��Ϊ��Ӧ ��ѡ������ȡ������ȡ�����
(4)����5���뼱�����£��ϸ���ƻ���ʱ�䣬��Ŀ���� ��
(5)��֪ˮ�����ڼ��������¾��л�ԭ�ԣ��磺N2H4+2I2=N2+4HI�����ⶨˮ���µ����������ɲ������в��裺
a��ȷ��ȡ2.000g���������ܽ⡢ת�ơ����ݵȲ��裬����250mL��Һ��
b����ȡl0.00 mL����ƿ�У�����20mLˮ��ҡ�ȣ�
c����0.l000 mol/L����Һ�ζ�����Һ������ɫ��Imin�ڲ���ʧ����¼���ĵ�ı�Һ�������
d����һ�����������ݴ���
�ٵζ�ʱ����ı���Һʢ���� �ζ����У�ѡ�����ʽ����ʽ������
�������εζ����ĵ�ı���ҺΪ18.00mL���ɲ������Ʒ��N2H4-H2O����������Ϊ ��
��Ϊ��ø��ɿ��ĵζ����������d�н�һ��������Ҫ�ǣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
![]()
��1������ʼʱ���Ͷ��2 mol SO2��1 mol O2���Ҳ�Ͷ��1 mol N2��4 mol H2���ﵽƽ��������¶���ͬ���������Ƿ�����Դ�������_______________������ܡ������ܡ�����
��2����ʼʱͶ��2 mol SO2��1 mol O2��1 mol N2,2 mol H2����ƽ��ʱ�������Դ������룬��SO2��ת������N2ת����֮��Ϊ����(SO2)�æ�(N2)=_______________���������֣�
��3������ʼʱͶ��2 mol SO2��1 mol O2;1 mol N2,a mol H2,0.1 mol NH3����ʼʱ�Ҳ����С������������aֵ��һ����Χ�ڱ仯ʱ������ͨ�����ڷ�Ӧ���¶ȣ�ʹ�������෴Ӧ���ﵽƽ�⣬��ƽ��ʱ���崦�����룬��ʱSO2��ת������N2ת����֮��Ϊ5��1����a��ȡֵ��Χ��
��4������ʼʱͶ��2 mol SO2,1 mol O2�����ü�ʵ�鷽�����Բⶨƽ��ʱSO2��ת���ʣ���ɽ�����ƽ��������ͨ��������______________������ţ���
A.̼������̼�����ƻ����Һ B.�Ȼ�����Һ
C.98.3%��Ũ���� D.���ᱵ�����Һ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com