
研究氨氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
2NO(g)+Cl2(g) 2ClNO(g) K2 ΔH2<0(Ⅱ)
2ClNO(g) K2 ΔH2<0(Ⅱ)
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=________(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=________(用K1、K2表示)。
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min时反应(Ⅱ)达到平衡。测得10 min内v(ClNO)=7.5×10-3 mol·L-1·min-1,则平衡后n(Cl2)=________mol,NO的转化率α1=________。其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2________α1(填“>”“<”或“=”),平衡常数K2______(填“增大”“减小”或“不变”)。若要使K2减小,可采取的措施是________。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH===NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1 L溶液A,溶液B为0.1 mol·L-1的CH3COONa溶液,则两溶液中c(NO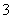 )、c(NO
)、c(NO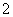 )和c(CH3COO-)由大到小的顺序为____________________________________________。(已知HNO2电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)
)和c(CH3COO-)由大到小的顺序为____________________________________________。(已知HNO2电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)
可使溶液A和溶液B的pH相等的方法是________。
a.向溶液A中加适量水
b.向溶液A中加适量NaOH
c.向溶液B中加适量水
d.向溶液B中加适量NaOH
(1)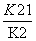
(2)2.5×10-2 75% > 不变 升高温度
(3)c(NO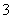 )>c(NO
)>c(NO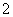 )>c(CH3COO-) b、c
)>c(CH3COO-) b、c
[解析] (1)反应(Ⅰ)×2-反应(Ⅱ)即得到反应:4NO2(g)+2NaCl(s) 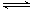
 2NaNO3(s)+2NO(g)+Cl2(g),利用平衡常数定义可知该反应平衡常数K=
2NaNO3(s)+2NO(g)+Cl2(g),利用平衡常数定义可知该反应平衡常数K=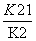 。(2)平衡时容器中n(ClNO)=7.5×10-3mol·L-1·min-1×10 min×2 L=0.15 mol,则平衡后n(Cl2)=0.1 mol-
。(2)平衡时容器中n(ClNO)=7.5×10-3mol·L-1·min-1×10 min×2 L=0.15 mol,则平衡后n(Cl2)=0.1 mol-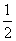 ×0.15 mol=0.025 mol;NO的转化率=
×0.15 mol=0.025 mol;NO的转化率=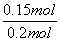 ×100%=75%;若恒压下达到平衡态相当于将原平衡加压,平衡正向移动,NO的转化率增大;平衡常数只与温度有关,恒压下达到平衡的平衡常数与原平衡常数相等;因该反应为放热反应,升高温度,反应逆向进行,反应平衡常数减小 。(3)反应后得到溶液A为物质的量浓度均为0.1 mol/L的NaNO2与NaNO3的混合溶液,利用已知电离常数可知CH3COO-水解程度大于NO
×100%=75%;若恒压下达到平衡态相当于将原平衡加压,平衡正向移动,NO的转化率增大;平衡常数只与温度有关,恒压下达到平衡的平衡常数与原平衡常数相等;因该反应为放热反应,升高温度,反应逆向进行,反应平衡常数减小 。(3)反应后得到溶液A为物质的量浓度均为0.1 mol/L的NaNO2与NaNO3的混合溶液,利用已知电离常数可知CH3COO-水解程度大于NO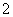 ,NO
,NO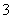 不发生水解,两溶液中c(NO
不发生水解,两溶液中c(NO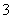 )>c(NO
)>c(NO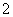 )>c(CH3COO-);利用CH3COO-水解程度大于NO
)>c(CH3COO-);利用CH3COO-水解程度大于NO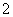 可知溶液B的碱性强于溶液A,为使溶液A、B的pH相等,可采取的措施有向溶液A中加适量NaOH或向B溶液中加入适量水稀释或向B溶液中加入适量稀醋酸等。
可知溶液B的碱性强于溶液A,为使溶液A、B的pH相等,可采取的措施有向溶液A中加适量NaOH或向B溶液中加入适量水稀释或向B溶液中加入适量稀醋酸等。


科目:高中化学 来源: 题型:
在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应,各物质的起始加入量如下:A、B和C均为4.0 mol、D为6.5 mol、F为2.0 mol,设E为x mol,当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器的正中位置,请填写以下空白。
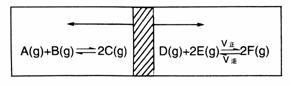
(1)若x=4.5,则右侧反应在起始时向__________(填“正反应”或“逆反应”)方向进行,要使起始反应维持向该方向进行,则x的取值范围__________。
(2)若x=4.5和5.0,则在这种情况下,当反应达平衡时,A的物质的量是否相等?__________(填“相等”、“不相等”或“不能确定”),其理由是__________________。\
查看答案和解析>>
科目:高中化学 来源: 题型:
肼(N2H4)—空气燃料电池是一种环保碱性燃料电池,其电解质溶液是20%—30%的KOH溶液。电池总反应为:N2H4+O2=N2↑+2H2O。下列关于该燃料电池工作时的说法正确的是( )
A.溶液中阴离子物质的量基本不变
B.正极的电极反应式是:O2+4H++4e-=2H2O
C.正极的电极反应式是:N2H4+4OH――4e-=H2O+N2↑
D.溶液中阴离子向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A.水的电离程度始终增大
B.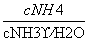 先增大再减小
先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10 mL时,c(NH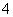 )=c(CH3COO-)
)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2===Na2S2O5。
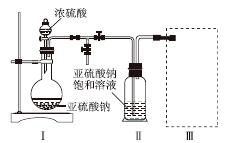
(1)装置Ⅰ中产生气体的化学方程式为______________________________________。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是______。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。
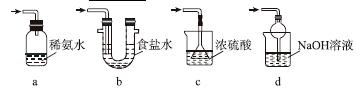
实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO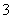 的电离程度大于水解程度,可采用的实验方法是________(填序号)。
的电离程度大于水解程度,可采用的实验方法是________(填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液
c.加入盐酸 d.加入品红溶液
e.用蓝色石蕊试纸检测
(5)检测Na2S2O5晶体在空气中已被氧化的实验方案是
________________________________________________________________________
________________________________________________________________________。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O===H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测定结果________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol·L-1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O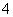 )
)
D.pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
研究氨氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
2NO(g)+Cl2(g) 2ClNO(g) K2 ΔH2<0(Ⅱ)
2ClNO(g) K2 ΔH2<0(Ⅱ)
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=________(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=________(用K1、K2表示)。
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10 min时反应(Ⅱ)达到平衡。测得10 min内v(ClNO)=7.5×10-3 mol·L-1·min-1,则平衡后n(Cl2)=________mol,NO的转化率α1=________。其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2________α1(填“>”“<”或“=”),平衡常数K2______(填“增大”“减小”或“不变”)。若要使K2减小,可采取的措施是________。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH===NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1 L溶液A,溶液B为0.1 mol·L-1的CH3COONa溶液,则两溶液中c(NO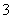 )、c(NO
)、c(NO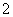 )和c(CH3COO-)由大到小的顺序为____________________________________________。(已知HNO2电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)
)和c(CH3COO-)由大到小的顺序为____________________________________________。(已知HNO2电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)
可使溶液A和溶液B的pH相等的方法是________。
a.向溶液A中加适量水
b.向溶液A中加适量NaOH
c.向溶液B中加适量水
d.向溶液B中加适量NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.pH=1的溶液中:Na+、K+、MnO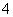 、CO
、CO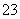
B.c(H+)=1×10-13 mol·L-1的溶液中:Mg2+、Cu2+、SO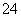 、NO
、NO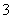
C.0.1 mol·L-1NH4HCO3溶液中:K+、Na+、NO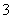 、Cl-
、Cl-
D.0.1 mol·L-1FeCl3溶液中:Fe2+、NH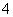 、SCN-、SO
、SCN-、SO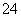
查看答案和解析>>
科目:高中化学 来源: 题型:
锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。当生成1 mol硝酸锌时,被还原的硝酸的物质的量为:
A.2 mol B.1 mol
C.0.5 mol D.0.25 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com