
【题目】标准状况下,将20LCO2和CO的混合气全通过足量的Na2O2粉末,在相同状况下,气体体积减少到16L,则原混合气体中CO的体积为
A.4LB.8LC.12LD.16L
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
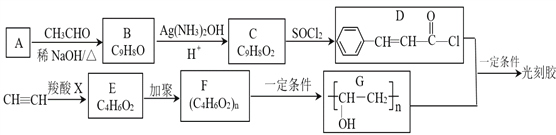
【题目】光刻胶的一种合成路线如下:
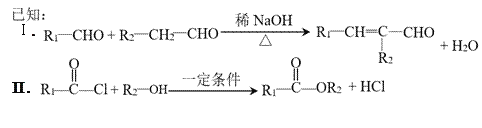
Ⅲ.RCOOH+CH![]() CH
CH![]() RCOOCH=CH2
RCOOCH=CH2
回答下列问题:
(1)A的名称是_______。C中所含官能团的名称是______。
(2)C→D的反应类型是___________,X的结构简式为___________。
(3)D+G→光刻胶的化学方程式_______________________________。
(4)T是C的同分异构体,T具有下列性质或特征:
①能发生水解反应和银镜反应;
②能使溴水褪色;
③属于芳香族化合物。则T的结构有_________种。其中核磁共振氢谱为5组峰,且峰面积比为1∶1∶2∶2∶2的结构简式为___________________________。
(5)根据已有知识并结合相关信息,写出以CH3CH2OH为原料制备CH3CH2CH2COOH的合成路线流程图(无机试剂任用)_________________________。
(合成路线流程图示例如下:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们习惯上把金、银、铜、铁、锡五种金属统称为“五金”。在“五金”顺序中,把一种金属的位置向后移一位,正好符合某化学规律。这种金属和该化学规律是( )
A. 铁、金属活动性顺序 B. 金、质量守恒定律
C. 银、质量守恒定律 D. 铜、金属密度顺序
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】〔化学-化学与技术〕
工业中以铝土矿(主要成分为Al2O3,另含有Fe2O3和SiO2)为原料冶炼铝过程如图所示:

(1) 实验室进行过滤用到的玻璃仪器有烧杯、_____________、_____________。
(2) 操作II中生成不溶物C的离子方程式是 。
(3) 氧化铝的熔点高达2050℃,工业上为降低能耗,在铝的电解冶炼时,采取的措施是 。
(4) 电解冶炼铝时,阳极和阴极以碳素材料制成,电解过程中,阳极材料需定期进行更换,原因是 。
(5) 为了提高综合经济效益,实际工业生产中常将上述反应中的相关物质循环利用。其部分转化关系如下图所示:
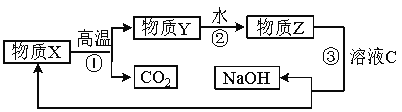
① 上述转化中未涉及四种基本反应类型中的 反应;
② 写出过程③的化学方程式: 。
(6) 研究表明,人体过量吸入铝元素会严重危害身体健康。请你结合实际提出两条杜绝铝元素过量吸入的措施:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用不同的分类方法,可将金属氧化物分为不同的类别。例如,从某种意义上讲,可将Na2O、CuO、MgO、Fe2O3等归为一类,则下列氧化物中与它们同属一类的是
A. CaO B. Na2O2 C. Al2O3 D. Mn2O7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液的pH=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是
A. 1∶9 B. 1∶1 C. 1∶2 D. 1∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“反向燃烧”可将二氧化碳变燃料。回答下列问题:
(1)CO2的电子式为________________.
(2)美国橡树岭国家实验室成功利用表面成钉状材料的纳米碳及钠米铜,通电时可将温室气体二氧化碳与水直接转化为酒精。该反应的化学方程式为____________________________。
(3)Zn/ZnO热化学循环还原CO2制CO的原理如下图:
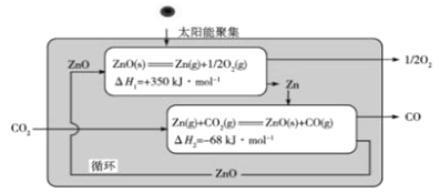
①从循环结果看,能量主要转化方式是________________________________。
②反应![]() △H= _______________kJ·mol-1。
△H= _______________kJ·mol-1。
(4)利用CO2与H2可直接合成二甲醚: ![]() ,当
,当![]() 时,实验测得CO2的平衡转化率随温度及压强变化如图1所示,二甲醚的产率随温度及压强变化如图2所示。
时,实验测得CO2的平衡转化率随温度及压强变化如图1所示,二甲醚的产率随温度及压强变化如图2所示。
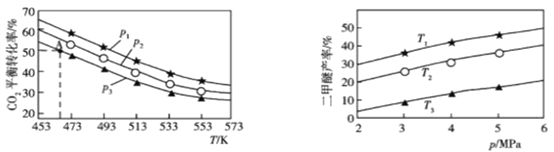
图1 图2
①该反应的△H________0(填“>”或“<”)。
②图1中压强(p)由大到小的顺序为______________________________。
③图2中温度(T)由大到小的顺序为______________________________。
④若在1L密闭容器中充入0.2mol CO2和0.6mol H2,平衡转化率对应图1中A点,则在此温度下该反应的平衡常数为________________________(保留整数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com