解:(1)实验室制备氯气中含有氯化氢和水蒸气,需要用饱和食盐水除去氯化氢,浓硫酸干燥氯气;
故答案为:除去Cl
2中混有的HCl,除去Cl
2中混有的水蒸气;
(2)装置D中是干燥的氯气和铜加热发生的反应,发生反应的化学方程式为:Cu+Cl
2
CuCl
2;
故答案为:Cu+Cl
2
CuCl
2;
(2)氯气有毒污染空气,不能排放到空气中,需要用氢氧化钠溶液吸收;
故答案为:吸收多余的Cl
2,防止污染空气;
(3)装置A中,如果反应产生氯气的体积为2.24L(标况)物质的量为0.1mol,则反应中被氧化的HCl的物质的量为0.2mol;
故答案为:0.2mol;
(5)氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,反应的化学方程式为:2Ca(OH)
2+2Cl
2=Ca(ClO)
2+CaCl
2+2H
2O;
故答案为:2Ca(OH)
2+2Cl
2=Ca(ClO)
2+CaCl
2+2H
2O;
(6)镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,在进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以正确的顺序为:②加过量的氢氧化钠溶液 ⑤加过量的氯化钡溶液 ④加过量的碳酸钠溶液 ①过滤 ③加适量盐酸;②⑤可互换;
故答案为:C;
分析:(1)实验室制备氯气中含有氯化氢和水蒸气,需要用饱和食盐水除去氯化氢,浓硫酸干燥氯气;
(2)装置D中是干燥的氯气和铜在加热时发生反应生成氯化铜;
(3)氯气有毒污染空气,不能排放到空气中;
(4)依据计算氯气物质的量,结合化学方程式分析被氧化的氯化氢是生成氯气的氯化氢;
(5)氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水;
(6)根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子进行分析.
点评:本题考查了实验室氯气制备的实验过程分析判断,氯气性质的应用,粗盐提纯的实验步骤是解题关键,题目难度中等.

 MnCl2+Cl2↑+2H2O)并设计如下实验装置用于制取纯净的无水氯化铜.回答有关问题:
MnCl2+Cl2↑+2H2O)并设计如下实验装置用于制取纯净的无水氯化铜.回答有关问题: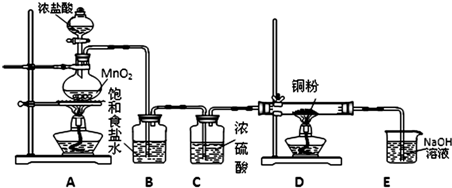
 CuCl2;
CuCl2; CuCl2;
CuCl2;

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
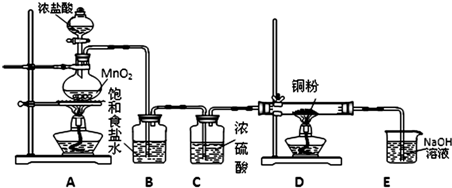
 MnCl2+Cl2↑+2H2O)并设计如下实验装置用于制取纯净的无水氯化铜.回答有关问题:
MnCl2+Cl2↑+2H2O)并设计如下实验装置用于制取纯净的无水氯化铜.回答有关问题: