
(14分)铜、铬都是用途广泛的金属。工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收金属铜和铬的流程如下图:

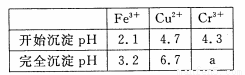
已知:部分物质沉淀的pH如下表:
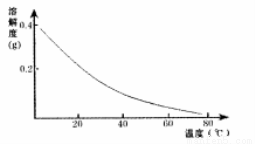
CaSO4的溶解度曲线如图:
请回答下列问题:
(1)滤液I中所含溶质主要有 (填化学式)。
(2)第②步操作中,先加人Ca(OH)2调节溶液的pH,调节范围为____,然后将浊液加热至80 ℃ 趁热过滤,所得滤渣Ⅱ的成分为 。
(3)第③步操作中,发现除了生成砖红色沉淀外,还产生了无色刺激性气味的气体。写出该步骤中发生反应的离子方程式
(4)当离子浓度≤1× 10-5mol· L-1 l时,可以认为离子沉淀完全。第④步操作中,若要使Cr3+完全沉淀,则室温下溶液中a的最小值为 。(已知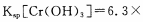
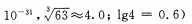
(5)Cr(OH)3受热分解为Cr2O3,用铝热法可以冶炼金属铬。写出铝热法炼铬的化学方程式
科目:高中化学 来源:2014-2015湖北省襄阳市高二3月月考化学试卷(解析版) 题型:填空题
(14分)红磷P(s)和Cl2 (g)发生反应生成PCl3(g)和 PCl5(g),反应过程如下。
2P(s) + 3Cl2(g) = 2PCl3(g) △H=-612kJ/mol
2P(s) + 5Cl2(g) = 2PCl5(g) △H=-798kJ/mol
请回答下列问题。
(1)气态 PCl5生成气态PCl3和Cl2的热化学方程式为 。
(2)PC15生成 PCl3和Cl2是一个可逆反应,向5.0L密闭容器中充入0.1 md PCl5(g),反应在不同条件下进行,反应体系总压强随时间的变化关系如图所示。
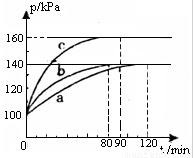
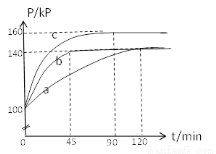
①实验b中PCl5的平衡分解率为 ,其他条件不变,在该实验中再加入 0.1 mol PCl5 (g) ,平衡分解率 (填“增大”、“减小”或“不变”)。
②与实验a相比,c改变的条件是 ,判断依据是 。
(3)PCl5露置于潮湿空气中,能水解生成两种中学化学常见酸,其化学方程式为 。
(4)人的牙齿表面有一层釉质,其组成为羟基磷灰石 Ca5( PO4)3OH(Ksp=6.8×10-37)。为了防止蛀牙,人们常使用含氟离子的牙膏,其中的氟化物可使轻基磷灰石转化为氟磷灰石Ca5( PO4)3F(Ksp=1.0×10-60)。写出该反应的离子方程式 ,该反应的平衡常数为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年新疆乌鲁木齐地区高三第二次诊断性测试化学试卷(解析版) 题型:选择题
镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。如图为“镁一次氯酸盐”燃料电池示意图,电极为镁合金和铂合金。关于该电池的叙述正确的是
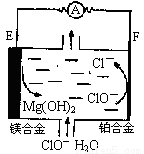
A.E为该燃料电池的正极
B.负极发生的电极反应式为ClO—+2e—+H2O=Cl—+2OH—
C.电池工作时,正极周围溶液的pH将不断变小
D.镁燃料电池负极能发生自腐蚀产生氢气,使负极利用率降低
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省高三下学期第一次模考化学试卷(解析版) 题型:填空题
(14分)
(1)已知:①N2(g)+O2(g)=2NO(g) △H=+179.5 kJ/mol
②2NO(g)+O2(g)=2NO2(g) △H=-112.3 kJ/mol
③2NO(g)+2CO(g)=N2(g) +2CO2(g) △H=-759.8 kJ/mol
NO2(g)+CO(g)=NO(g) +CO2(g) △H= kJ/mol。
(2)将不同物质的量的H2O(g)和CO(g)分别通入体积为2 L的恒容密闭容器中,进行反应:H2O(g)+CO(g)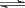 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min[ | ||
H2O | CO | CO | H2 | |||
① | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
② | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
③ | 900 | a | b | c | d | t |
①实验组①中以v(CO2)表示的反应速率为 ,此温度下的平衡常数为 ,温度升高时平衡常数会 (填“增大”、“减小”或“不变”)。
②650 ℃时,若在此容器中开始充入2 mol H2O(g)、 1 mol CO、 1 mol CO2和 2 mol H2,若要使反应在开始时 进行。(填“正向”、“逆向”)
③若a=2,b=1,则c= ,达平衡时实验组②中H2O(g)和实验组③中CO的转化率的关系为
α2 (H2O) α3 (CO)(填“<”、“>”或“=”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省高三下学期第一次模考化学试卷(解析版) 题型:选择题
化学在生产和日常生活中有着重要的应用。下列叙述正确的是
A.在有机化工中,氯气是合成塑料、橡胶、农药和人造纤维的重要原料
B.汽车尾气中含有氮的氧化物,是汽油不完全燃烧造成的
C.白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤方法除去
D.油脂是产生能量很高的营养物质,在饮食中不必控制油脂的摄入量
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省郑州市高三第二次质量预测理综化学试卷(解析版) 题型:选择题
向某含有SO32 -、SiO32 -、CO32 -、Br-、Na+的溶液中缓慢通入C12直至过量,下列对该反应过程的判断不正确的是
A、整个过程共发生2个氧化还原反应
B、所有阴离子的浓度都发生了变化
C、溶液的颜色发生了变化
D、反应过程中既有气体产生,也有沉淀产生
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市延庆县高三3月模拟理综化学试卷(解析版) 题型:推断题
(17分)一种功能性紫外光固化涂层胶JEA单体N的合成路线如下图所示:

已知:环氧烷可以发生加成反应: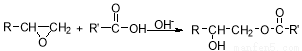
(1)A是一种烃,其蒸气密度为同温同压下H2密度的21倍。A的分子式为__________。
(2)写出A→B的化学方程式____________________。
(3)已知D分子中含有三元环结构,则D的结构简式为_______。
②、③两种途径均可得到D,你认为符合“原子经济”要求的合成的途径为 (填序号)。
(4)已知F不能发生银镜反应,则E→F的化学方程式为___________。
(5)BPA又名双酚A其结构简式如下图所示,下列说法正确的是__________。

a.1mol双酚A与浓溴水发生反应最多消耗4molBr2
b.核磁共振氢谱有4组峰,峰面积之比为3:2:2:1
c.可发生加成、取代、消去等反应
(6)G能使溴的四氯化碳溶液褪色,且可以与新制的Cu(OH)2悬浊液发生反应生成红色沉淀,写出该反应的方程式__________________。
(7)已知N的结构简式如下:
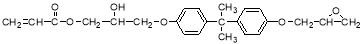
由D、BPA、H合成N的反应类型有 。
(8)请任意写出符合下列条件的两种有机物的结构简式(含顺反异构)_______、______。
①与H互为同系物 ②其相对分子质量为86
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市门头沟区高三3月综合练习理综化学试卷(解析版) 题型:选择题
下列解释事实的方程式正确的是
A.向AgCl沉淀中滴入饱和KI溶液反应的离子方程式:AgCl + I- = AgI + Cl-
B.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++OH-+H++SO42-= BaSO4↓+H2O
C.向A1C13溶液中加入过量的氨水:Al3++4NH3·H2O = AlO2-+ 4NH4+ + 2H2O
D.向Ca(ClO)2溶液中通入适量SO2 :Ca2++2ClO-+SO2+H2O = CaSO3↓+2HClO
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省韶关市高三调研考试理综化学试卷(解析版) 题型:选择题
用下列装置图进行相应的实验,其中正确的是

A.用图1可比较硫、碳、硅三种元素的非金属性强弱
B.用图2装置收集一瓶纯净的NO
C.用图3装置中U型管两端有液面差且保持不变时证明装置不漏气
D.用图4检验溴乙烷与NaOH的醇溶液共热产生的乙烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com