
| A. | ①③ | B. | ② | C. | ①② | D. | ②③ |
分析 根据化学平衡移动原理:增大压强,化学平衡向着气体体积减小的方向进行;升高温度,化学平衡向着吸热方向进行,据此结合选项解答.
解答 解:①正反应为体积减小的反应,增大压强,平衡正向移动,正反应是放热反应,降低温度平衡正向移动,故①不符合;
②正反应为体积增大的反应,增大压强,平衡逆向移动,正反应是吸热反应,降低温度平衡逆向移动,故②符合;
③正反应为体积减小的反应,增大压强,平衡正向移动,正反应是放热反应,降低温度平衡正向移动,故③不符合;
④反应前后体积不变,增大压强平衡不移动,正反应是吸热反应,降低温度平衡逆向移动,故④不符合;
故选B.
点评 本题考查温度和压强对化学平衡移动的影响,注意根据反应特征利用平衡移动原理解答,难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 定样品中Na2O2的含量.
定样品中Na2O2的含量.
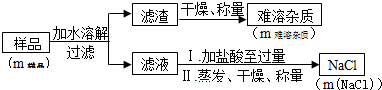
| m样品 | m难溶杂质 | m(NaCl) |
| 8.00g | 0.42g | 10.53g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 0.1 mol•L-1的CuCl2溶液中含Cu2+为0.1NA | |
| B. | 标准状况下,22.4 L CCl4含CCl4分子为NA | |
| C. | 1mol H3O+含质子数为10 NA | |
| D. | 1mol Na2O2混合物中含阴离子的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸保存在棕色玻璃试剂瓶中 | |
| B. | 少量的钠保存在煤油中 | |
| C. | 新制的氯水通常保存在棕色玻璃试剂瓶中 | |
| D. | 氢氧化钠溶液用带磨口玻璃塞的普通试剂瓶贮存 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com