
 氮化硅是一种重要的结构陶瓷材料,具有优良性能.
氮化硅是一种重要的结构陶瓷材料,具有优良性能.分析 (1)N原子核外电子数为7,由能量最低原理可知核外电子排布式为1s22s22p3;同周期自左而右电负性增大,同主族自上而下电负性减小;
(2)碳热还原法制氮化硅是在氮气中用碳还SiO2,反应生成Si3N4、CO,氮化硅一般不与酸反应,但能与氢氟酸反应,反应生成SiF4与NH4F;
(3)三氯化硅烷(SiHCl3)分子中Si原子形成4个σ键,没有孤对电子,杂化轨道数目为4;
(4)氮化硅、碳化硅晶体中原子之间形成共价键,键能大;
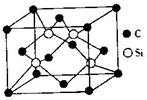
(5)碳化硅立方晶系晶胞中,体内Si原子与周围的4个C原子形成正四面体结构;原子之间形成共价键,向空间延伸的立体网状结构,属于原子晶体;根据均摊法计算晶胞中Si、C原子数目,用阿伏伽德罗常数表示出晶胞质量,再结合m=ρV计算晶胞体积,而晶胞棱长=$\root{3}{{V}_{晶胞}}$.
解答 解:(1)N原子核外电子数为7,由能量最低原理可知核外电子排布式为1s22s22p3,2p能级3个电子分别占据1个轨道,单电子数目为3,同周期自左而右电负性增大,同主族自上而下电负性减小,故电负性N>C>Si,
故答案为:1s22s22p3;3;N>C>Si;
(2)碳热还原法制氮化硅是在氮气中用碳还SiO2,反应生成Si3N4、CO,化学方程式为:6C+2N2+3SiO2$\frac{\underline{\;\;△\;\;}}{\;}$Si3N4+6CO,氮化硅一般不与酸反应,但能与氢氟酸反应,反应生成SiF4与NH4F,反应方程式为:Si3N4+16HF=3SiF4+4NH4F,
故答案为:6C+2N2+3SiO2$\frac{\underline{\;\;△\;\;}}{\;}$Si3N4+6CO;Si3N4+16HF=3SiF4+4NH4F;
(3)三氯化硅烷(SiHCl3)分子中Si原子形成4个σ键,没有孤对电子,三氯硅烷分子的空间构型为四面体形,杂化轨道数目为4,Si原子采取sp3杂化,
故答案为:四面体形;sp3杂化;
(4)氮化硅、碳化硅晶体中原子之间形成共价键,键能大,键牢固,化学性质稳定,
故答案为:晶体中原子之间形成共价键,键能大,键牢固;
(5)碳化硅立方晶系晶胞中,体内Si原子与周围的4个C原子形成正四面体结构,C-Si-C键的夹角是109°28′;原子之间形成共价键,向空间延伸的立体网状结构,属于原子晶体;
晶胞中Si原子数目为4、C原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则晶胞质量为$\frac{4×(28+12)}{{N}_{A}}$g,化硅密度为ρg•cm-3,则晶胞棱长=$\root{3}{\frac{\frac{4×(28+12)}{{N}_{A}}}{ρg•c{m}^{-3}}}$=$\root{3}{\frac{160}{ρ{N}_{A}}}$cm,
故答案为:109°28′;原子晶体;$\root{3}{\frac{160}{ρ{N}_{A}}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电负性、杂化方式与空间构型判断、晶胞计算等,掌握均摊法进行晶胞有关计算,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
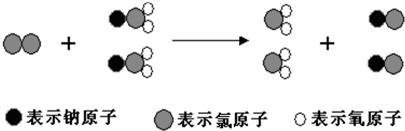
| A. | 该反应的化学方程式为Cl2+2NaClO2═2ClO2+2NaCl | |
| B. | 该反应是应是复分解反应 | |
| C. | 反应中Cl2既是氧化剂,又是还原剂 | |
| D. | NaClO2和ClO2中Cl元素的化合价相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 电解NaOH溶液时,溶液浓度将增大,pH增大 | |
| B. | 电解H2SO4溶液时,溶液浓度将增大,pH增大 | |
| C. | 电解Na2SO4溶液时,溶液浓度将增大,pH不变 | |
| D. | 电解NaCl溶液时,溶液浓度将减小,pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量都为4.4g的CH3CHO和CO2含有的分子数均为0.1NA | |
| B. | 1molNa2O2中的离子总数为4NA | |
| C. | 密闭容器中,2molSO2和足量的O2反应转移的电子数为4NA | |
| D. | 1mol苯分子中所含的碳碳双键数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 实验内容 | 实验目的 |
| A | 常温下,测得饱和Na2CO3溶液的pH大于饱和 NaHCO3溶液的pH | 比较常温下水解程度: CO32->HCO3- |
| B | 向2mL甲苯中加入3滴KMnO4酸性溶液,振荡; 向2mL己烷中加入3滴KMnO4酸性溶液,振荡 | 证明与苯环相连的甲基易被氧化 |
| C | 向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶 液,前者为黄色,后者为红褐色 | 证明温度升高,Fe3+的水解程度 增大 |
| D | 向盛有10滴0.1mol/LAgNO3溶液的试管中滴加0.1mol/L NaCl溶液,至不再有沉淀生成,再向其中滴加0.1mol/L Na2S溶液 | 证明AgCl沉淀能转化为溶解度更小 的Ag2S沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g) 所具有的总能量低 | |
| B. | 氢气的燃烧热为△H=-241.8 kJ•mol-1 | |
| C. | H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量 | |
| D. | 液态水分解的热化学方程式为:2H2O(l)═2H2(g)+O2(g)△H=+571.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
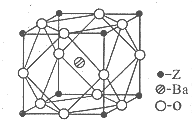 A、B、C、D、Z为周期表前四周期元素,原子序数依次递增,已知:
A、B、C、D、Z为周期表前四周期元素,原子序数依次递增,已知:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纳米铜比纳米铁金属活动性更强 | |
| B. | 纳米铜在反应中可能作氧化剂 | |
| C. | 纳米TiO2在不同溶剂中均形成了胶体 | |
| D. | 纳米TiO2有很强的氯化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com