
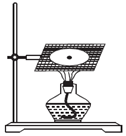
 某化学实验小组拟用如图装置进行钠与氧气反应的实验.
某化学实验小组拟用如图装置进行钠与氧气反应的实验.分析 (1)将金属钠放在氧气中燃烧,金属钠先熔化,然后燃烧,火焰呈黄色,生成物是淡黄色过氧化钠固体;
(2)单质与化合物反应生成新的单质和新的化合物的反应属于置换反应;置换反应都属于氧化还原反应.
解答 解:(1)将金属钠放在氧气中燃烧,金属钠的熔点较低,看到金属钠先熔化,然后燃烧,燃烧时火焰呈黄色,生成淡黄色固体,化学方程式为2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2;
故答案为:钠先熔化,接着燃烧,产生黄色火焰,并生成淡黄色固体;2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2.
(2)2Na+CO2$\frac{\underline{\;点燃\;}}{\;}$C+Na2O2或4Na+3CO2$\frac{\underline{\;点燃\;}}{\;}$C+2Na2CO3,两个反应都属于置换反应,存在元素化合价的变化,属于氧化还原反应;
故答案为:置换;氧化还原.
点评 本题考查的是钠的物理性质、化学性质属、氧化还原反应,碱金属是典型金属元素的代表,钠是碱金属元素的代表,在无机化学中有非常重要的地位,题目难度不大.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 巴蜀化学课外小组用海带为原料制取了少量碘水,现用CCl4 (沸点76.8℃)从碘水中萃取碘并用分液漏斗分离两种溶液.实验操作可分解为如下几步:
巴蜀化学课外小组用海带为原料制取了少量碘水,现用CCl4 (沸点76.8℃)从碘水中萃取碘并用分液漏斗分离两种溶液.实验操作可分解为如下几步:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装时期 | |
| 分装企业 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
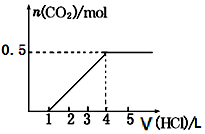 一定量CO2通入某浓度的NaOH溶液中,反应后得到溶液A,向A溶液中逐滴滴入某浓度稀盐酸,加入V(HCl)与生成n(CO2)的关系如图所示.下列有关叙述正确的是( )
一定量CO2通入某浓度的NaOH溶液中,反应后得到溶液A,向A溶液中逐滴滴入某浓度稀盐酸,加入V(HCl)与生成n(CO2)的关系如图所示.下列有关叙述正确的是( )| A. | 通入的CO2气体为11.2 L | B. | A溶液中n(NaHCO3)=2n(Na2CO3) | ||
| C. | A溶液中既含NaOH,又含Na2CO3 | D. | A溶液中一定只有Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com