
分析 (1)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(2)①依据化学方程式和平衡常数概念写出平衡常数表达式;
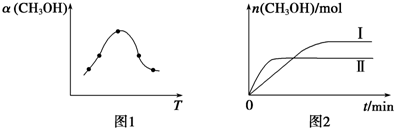
②由图可知最高点反应到达平衡,到达平衡后,温度越高,α(CH3OH)越小,升高温度平衡向逆反应进行,据此判断;
③由图象分析先拐先平,温度高TⅡ先达到平衡则TⅡ>TⅠ,纵轴是甲醇的物质的量,温度越高,甲醇越少,平衡逆向进行分析判断;
(3)①根据反应物、反应条件、生成物写出化学反应式;利用三段式法计算;
②根据原电池原理,CO2在正极发生还原反应转化为甲烷,注意电解质溶液为酸性.
解答 解:(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
依据盖斯定律①-②×3得到Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1;
故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1;
(2)①平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以K=$\frac{c(CH{\;}_{3}OH)•c(H{\;}_{2}O)}{c(CO{\;}_{2})•c{\;}^{3}(H{\;}_{2})}$,
故答案为:$\frac{c(CH{\;}_{3}OH)•c(H{\;}_{2}O)}{c(CO{\;}_{2})•c{\;}^{3}(H{\;}_{2})}$;
②由图可知最高点反应到达平衡,达平衡后,温度越高,α(CH3OH)越小,平衡向逆反应进行,升高温度平衡吸热方向进行,逆反应为吸热反应,则正反应为放热反应,即△H<0,
故答案为:<;
③由图2可知,温度TⅠ<TⅡ,平衡时,温度越高CO的转化率越小,说明升高温度,平衡向逆反应移动,升高温度平衡向吸热反应移动,故该反应正反应为放热反应,则△H<0,升高温度,平衡向逆反应移动,所以KⅠ>KⅡ,
故答案为:>;
(3)①根据反应物是二氧化碳和氨气(NH3),反应条件是高温、高压,生成物是尿素[CO(NH2)2]和水,化学反应式为2NH3+CO2$\stackrel{一定条件}{?}$CO(NH2)2+H2O,
设CO2的初始物质的量为a,则NH3的初始物质的量为3a,
2NH3+CO2$\stackrel{一定条件}{?}$CO(NH2)2+H2O
起始/mol 3a a
转化/mol 1.2a 0.6a
平衡/mol 1.8a 0.4a
平衡时NH3转化率为:$\frac{1.2a}{3a}$×100%=40%,
故答案为:2NH3+CO2$\stackrel{一定条件}{?}$CO(NH2)2+H2O;40%;
②CO2在正极发生还原反应转化为甲烷,考虑电解质为硫酸,所以甲烷中氢来源为硫酸电离的氢离子,根据化合价变化可知1mol二氧化碳变成甲烷得到8mol电子,故电极反应为:CO2+8e-+8H+=CH4+2H2O,
故答案为:CO2+8e-+8H+=CH4+2H2O.
点评 本题考查了热化学方程式的书写、化学平衡移动、平衡常数概念理解、转化率的计算及原电池原理的分析应用等,题目涉及的知识点较多,综合性较强,难度中等.分析图象时,要考虑先拐先平衡的原则,则反应条件为温度高或压强大,写电极反应式一定要考虑介质的参与.


科目:高中化学 来源: 题型:选择题
| A. | 100g/mol | B. | 108g/mol | C. | 55g/mol | D. | 96g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 替代,请将Br2与Na2CO3反应的化学方程式补充完整
替代,请将Br2与Na2CO3反应的化学方程式补充完整查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20 | B. | 16 | C. | 9 | D. | 25 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com