
【题目】下列各组物质,不能按 ![]() (“→”表示反应一步完成)关系转化的是( )
(“→”表示反应一步完成)关系转化的是( )
选项 | a | b | c |
A | Fe | FeCl3 | FeCl2 |
B | NaOH | NaHCO3 | Na2CO3 |
C | Al | Al(OH)3 | Al2O3 |
D | MgCl2 | Mg(OH)2 | MgO |
A. A B. B C. C D. D
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】0.5L 1mol/L FeCl3溶液与0.2L1mol/L KCl溶液中的Cl-的数目之比
A. 5:2 B. 3:1 C. 15:2 D. 1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如图所示的转化关系: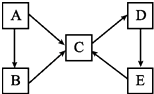
(1)若A为单质,C、D的相对分子质量相差16,0.05 molL﹣1 E溶液中只有3种离子,且在25℃时,溶液中的 ![]() =1012 . ①若B为气态氢化物,写出E→C的一个化学方程式 .
=1012 . ①若B为气态氢化物,写出E→C的一个化学方程式 .
②在A→C的反应中,每转移1 mol e﹣就会放热143.5 kJ,写出该反应的热化学方程式 .
(2)若A为单质,B、C均属于盐类,D是一种白色沉淀.①若B的水溶液呈酸性,C的水溶液呈碱性,C溶液呈碱性的原因是(用离子方程式表示).
②若B溶液呈黄色,与硫氰化钾溶液混合后显红色,E是一种不溶性碱.则:
(Ⅰ)B→C的离子方程式为 .
(Ⅱ)D→E的化学方程式为 .
(Ⅲ)选用一种试剂R与E反应实现E→C的转化,则R为;该反应的离子方程式为 .
(3)若A~E均为化合物,且均含有元素Y.A是淡黄色固体,B、C两溶液在等物质的量浓度时,C溶液的pH较小.电解D的水溶液是最重要的工业生产之一,D→E→C也是工业制备C的普遍方法.Y的单质与钾的合金可在核反应堆中用作热交换液.5.05 g Y钾合金溶于200 mL水生成0.075 mol氢气,计算并确定该Y钾合金的化学式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于加成反应的是( )
A.乙烯使酸性KMnO4溶液褪色
B.将苯滴入溴水中,振荡后水层接近无色
C.乙烯使溴的四氯化碳溶液褪色
D.甲烷与氯气混合,光照一段时间后黄绿色消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液里存在重要的酸碱平衡:CO2+H2OH2CO3 ![]() HCO3﹣ , 使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒.其pH随c(HCO3﹣):c(H2CO3)变化关系如下表:
HCO3﹣ , 使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒.其pH随c(HCO3﹣):c(H2CO3)变化关系如下表:
c(HCO | 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
下列说法不正确的是( )
A.正常人体血液中,HCO ![]() 的水解程度大于电离程度
的水解程度大于电离程度
B.人体血液酸中毒时,可注射NaHCO3溶液缓解
C.pH=7.00的血液中,c(H2CO3)<c(HCO ![]() )
)
D.pH=7.40的血液中,HCO ![]() 的水解程度一定大于H2CO3的电离程度
的水解程度一定大于H2CO3的电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.实验室可用KMnO4和浓盐酸反应制取氯气。
2KMnO4+16HCl(浓) ![]() 2KCl+2MnCl2+5Cl2↑+8H2O
2KCl+2MnCl2+5Cl2↑+8H2O
(1)用单线桥标出电子转移的方向和数目。____________________
(2)将上述配平的化学方程式改写为离子方程式__________________________________ 。
(3)浓盐酸在反应中显示出来的性质是________________
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(4)若产生0.5molCl2,则被氧化的HCl________mol,转移的电子的数目约为____________。
II.根据反应Cu+4HNO3(浓)![]() Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
①还原产物是______。
②氧化剂与氧化产物的物质的量之比是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mLBaCl2、AlCl3、FeCl3 的混合溶液A中逐滴加入Na2SO4和NaOH的混合溶液B,产生沉淀的物质的量n和加入溶液B的体积关系如图所示: 
(1)当加入110mLB溶液时,溶液中的沉淀是(填化学式).
(2)溶液B中Na2SO4和NaOH的物质的量浓度之比是 . 当B溶液加到90mL~100mL这一段时间中,所发生的离子反应方程式是
(3)将A、B溶液中各溶质的物质的量浓度(c)填入下表中.
溶质 | Na2SO4 | NaOH | BaCl2 | AlCl3 | FeCl3 |
c/molL﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒容密闭容器中充入一定量SO2和O2进行反应:2SO2(g)+O2(g)2SO3(g)△H<0.反应速率(v)与温度(T)、SO2的体积分数[v(SO2)%]与压强(P)的关系分别如图甲、图乙所示.下列说法不正确的是( )
A.图甲中,曲线1表示逆反应速率与温度的关系
B.图甲中,d点表示温度为T0时,反应已经达到平衡
C.图乙中,温度恒定时,a、b两点对应的反应速率:va>vb
D.图乙中,温度恒定时,c点的反应正在向逆反应方向进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com