

科目:高中化学 来源: 题型:阅读理解

 阴极获得钛可能发生的反应或电极反应为:
阴极获得钛可能发生的反应或电极反应为: ,下列说法正确的是
,下列说法正确的是查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
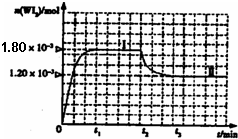 (2010?枣庄一模)卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义.
(2010?枣庄一模)卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义.

| ||
| ||
| 0.036 |
| t1 |
| 0.036 |
| t1 |
| [WI2] |
| [W][I2] |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 TiCl4(l)+O2 (g);△H=+151kJ/mol反应难于发生,所以工业上不能直接由TiO2和Cl2反应来制取TiCl4.当反应体系中加入碳后,反应分如下两步进行(如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热相同).
TiCl4(l)+O2 (g);△H=+151kJ/mol反应难于发生,所以工业上不能直接由TiO2和Cl2反应来制取TiCl4.当反应体系中加入碳后,反应分如下两步进行(如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热相同). TiCl4 (l)+2CO (g);△H=
TiCl4 (l)+2CO (g);△H= TiCl4(l)+O2 (g)顺利进行的原因是
TiCl4(l)+O2 (g)顺利进行的原因是
查看答案和解析>>
科目:高中化学 来源: 题型:
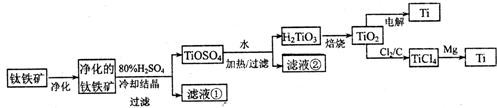
查看答案和解析>>
科目:高中化学 来源: 题型:
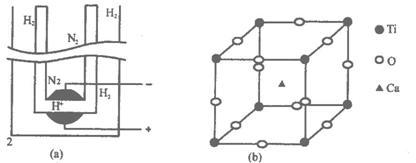
(1)写出上述电解池阴、阳两极发生的反应和电解池的总反应方程式。
阳极_______________________________________________________________;
阴极_______________________________________________________________;
总反应方程式_________________________________________________________。
(2)钙钛矿晶体中,每个钛原子周围与它最接近且等距离的钛原子共有_____个,氧、钙、钛(Ti)的原子个数比是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com