
A.溴水中有下列平衡Br2+H2O HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 |
| B.用热的纯碱溶液可增加去油污的能力 |
C.反应CO(g)+NO2(g) CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 |
| D.选择合适的催化剂可使水在较低温度下分解 |
科目:高中化学 来源:不详 题型:单选题
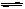 2NH3(g) ;△H=-92.4kJ/mol。
2NH3(g) ;△H=-92.4kJ/mol。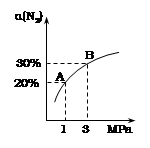
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 pC(g)+qD(g) 满足下列图象,根据图象判断四种关系正确的是
pC(g)+qD(g) 满足下列图象,根据图象判断四种关系正确的是
| A.m+n>p+q,正反应吸热 | B.m+n<p+q, 正反应放热 |
| C.m+n>p+q,正反应放热 | D.m+n<p+q, 正反应吸热 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.只有②③ | B.只有①③ | C.只有①④ | D.只有②④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g) ΔH,在不同温度下的化学平衡常数(K)如表所示。
CH3OH(g) ΔH,在不同温度下的化学平衡常数(K)如表所示。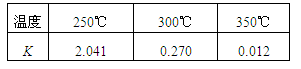
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H2(g)+ I2(g)(正反应为放热反应)达平衡。若升高温度,则
H2(g)+ I2(g)(正反应为放热反应)达平衡。若升高温度,则查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 xC(g),有如图(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线,则下列说法中正确的是
xC(g),有如图(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线,则下列说法中正确的是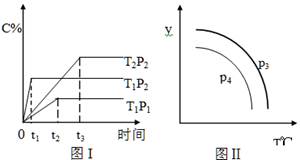
| A.x=2,T1>T2,P2>P1 |
| B.P3>P4,y轴表示B的质量分数 |
| C.P3<P4,y轴表示混合气体的密度 |
| D.P3>P4,y轴表示混合气体的平均摩尔质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com