
| A. | 炼铁目的是将生铁进行还原 | B. | 炼铁时加入石灰石除脉石 | ||
| C. | 炼钢目的是将生铁进行氧化 | D. | 炼钢时加入生石灰造渣 |
分析 A.根据炼铁的原理来分析;
B.根据石灰石中的碳酸钙在高温条件下分解能生成氧化钙和二氧化碳,氧化钙能和二氧化硅反应生成硅酸钙,从而除去铁矿石中的二氧化硅;
C.炼钢利用转炉内的氧化性环境将铁水中过量的碳氧化成一氧化碳和二氧化碳,达到钢水要求的碳含量;
D.氧化钙能和二氧化硅反应生成硅酸钙,从而除去铁矿石中的二氧化硅.
解答 解:A.炼铁的原理是利用还原剂高温还原铁的氧化物,故A错误;
B.石灰石中的碳酸钙在高温条件下分解能生成氧化钙和二氧化碳,氧化钙能和二氧化硅反应生成硅酸钙,从而除去铁矿石中的二氧化硅,即炼铁高炉中加入石灰石的目的是除去脉石(二氧化硅),故B正确;
C.炼钢利用转炉内的氧化性环境将铁水中过量的碳氧化成一氧化碳和二氧化碳,达到钢水要求的碳含量,不是生铁被氧化剂氧化,是碳被氧化,故C错误;
D.氧化钙能和二氧化硅反应生成硅酸钙,将矿石中的二氧化硅转变为炉渣,即作熔剂造渣,故D正确;
故选AC.
点评 本题考查了高炉炼铁的原料、原理,难度不大,属于对基础知识的考查.


科目:高中化学 来源: 题型:选择题
| A. | O2比O3质量小 | B. | 两气体分子数目相等 | ||
| C. | 两气体的压强相等 | D. | 两气体的氧原子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温度,同体积的N2和O2 | B. | 同质量,不同密度的N2和CO | ||
| C. | 同压强,同体积的H2和CH4? | D. | 同体积,同密度的CO2和N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Ki1的表达式为Ki1=$\frac{[{H}_{2}C{O}_{3}]}{[{H}^{+}][HC{{O}_{3}}^{-}]}$ | |
| B. | Ki2对应的电离过程是HCO3-+H2O?H3O++CO32- | |
| C. | 当碳酸的电离平衡正向移动时,Ki1与Ki2均相应增大 | |
| D. | 改变条件使Ki1减小,则Ki2一定也减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将滴有稀硫酸的淀粉溶液加热后,加入新制的Cu(OH)2悬浊液,加热,没有红色沉淀,说明淀粉在该条件下没有水解 | |
| B. | 将铜与足量的浓硝酸反应生成的气体干燥后收集,用冰水混合物冷却降温,研究温度对化学平衡的影响 | |
| C. | 将混合气体通过饱和Na2CO3溶液以便除去CO2中少量的SO2 | |
| D. | 某无色溶液中加入Ba(NO3)2溶液,再加稀盐酸,沉淀不溶解,则原溶液中一定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
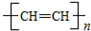 和聚合物A
和聚合物A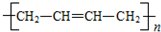 的说法中正确的是( )
的说法中正确的是( )| A. | 两种聚合物的单体互为同系物 | |
| B. | 聚合物A不属于单双键交错的结构. | |
| C. | 聚合物A的相对分子质量是聚乙炔的两倍 | |
| D. | 两种聚合物的单体各1 mol,分别与Br2发生加成反应时最多消耗Br2的物质的量之比为2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com