
【题目】物质分类和实验探究都是中学化学重要的学科思想。
(一)以下是对“一些物质与水反应”的分类图,请按要求填空:

上述分类方法是______;A组物质中属于电解质的是_____(填化学式);C组物质与水反应的离子方程式为_____;D组物质与水反应中,氧化剂和还原剂物质的量之比为1∶2的物质是___(填化学式)。
(二)用质量分数为98%的浓硫酸(密度为1.84 g·cm3)配制240 mL浓度为0.5 mol·L-1的硫酸溶液,选用到的仪器正确的是______(填序号)。

下列操作会使配制结果偏高的是_______(填序号)
A 容量瓶用蒸馏水洗净后,未进行干燥处理
B 稀释的硫酸转移到容量瓶中后未洗涤烧杯
C 未冷却,即将溶液注入容量瓶并定容
D定容时,俯视容量瓶的刻度线
(三)某小组用如下装置比较氯、溴、碘的非金属性强弱实验(夹持仪器已略去,气密性已检验)。

实验步骤:
①打开弹簧夹,打开活塞a,滴加浓盐酸;
②当B和C中的溶液都变为黄色时,夹紧弹簧夹;
③当B中溶液由黄色变为棕红色时,关闭活塞a;
④打开活塞b,将少量C中溶液滴入试管D中,关闭活塞b,取下试管D振荡,静置后CCl4层变为紫红色。
请回答:
(1)装置A中证明氯的非金属性强于碘的实验现象是_________。
(2)B中溶液发生反应的离子方程式是_______________。
(3)步骤③实验的目的是确认C的黄色溶液中无_____(填化学式)。步骤④能否说明非金属性:Br>I_______(填“能”或“否”)
【答案】树状分类法 Na2O 2Na+2H2O=2Na++2OH-+H2↑ NO2 AB CD 湿润的淀粉KI试纸变蓝 Cl2+2Br-=Br2+2Cl- Cl2 能
【解析】
此题体现了对三块内容的考察,一是通过化学分类方法考察了离子反应、氧化还原等相关内容,二是考察了一定物质的量浓度溶液的配置实验,三是以化学实验为背景考察了氯气的制备与性质。
(一)题图所示的分类方法为树状分类法;A组物质中属于电解质的是金属氧化物Na2O;C组物质与水反应,水只作氧化剂,因此C组物质只有Na,因此C组物质与水反应的方程式为2Na+2H2O=2Na++2OH-+H2↑;D组物质与水反应中,氧化剂和还原剂物质的量之比为1∶2的物质是NO2;
(二)用质量分数为98%的浓硫酸配制240 mL浓度为0.5 mol·L-1的硫酸溶液,是溶液的稀释,要用到量筒量取浓硫酸的体积,用容量瓶配置溶液,故应该选AB;
A 容量瓶用蒸馏水洗净后,未进行干燥处理,对浓度无影响;
B 稀释的硫酸转移到容量瓶中后未洗涤烧杯,会使浓度减小;
C 未冷却,即将溶液注入容量瓶并定容,会使浓度偏大;
D定容时,俯视容量瓶的刻度线,会使浓度偏大;
故应选CD;
(三)A装置是氯气的制备装置,其中湿润的淀粉-KI试纸是用来比较氯与碘的非金属性强弱的,装置BC用来比较氯与溴的非金属性,D装置用来比较Br和I的非金属性。
(1)装置A中证明氯的非金属性强于碘的实验现象是湿润的淀粉KI试纸变蓝;
(2)B中溶液发生反应的离子方程式是Cl2+2Br-=Br2+2Cl-;
(3)步骤③实验的目的是确认C的黄色溶液中无Cl2,步骤④能说明非金属性Br>I。


科目:高中化学 来源: 题型:
【题目】下面是第二周期部分元素基态原子的电子排布图,据此下列说法错误的是( )


A. 每个原子轨道里最多只能容纳2个电子
B. 电子排在同一能级时,总是优先单独占据一个轨道
C. 每个能层所具有的能级数等于能层的序数(n)
D. 若原子轨道里有2个电子,则其自旋状态相反
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业锅炉内壁的水垢,不仅浪费燃料,而且容易引发安全隐患。某碳素钢锅炉水垢(主要成分有CaCO3、CaSO4、Mg(OH)2、Fe2O3、SiO2等)碱煮法清除的流程如下:

已知:20℃时几种难溶物的溶度积常数如下表(单位省略):

回答下列问题:
(1)“碱煮”环节,加入Na3PO4的主要目的是将CaSO4转化为Ca3(PO4)2,请写出该离子方程式______________________。
(2)“浸泡过程中,稀盐酸会溶解Fe2O3。溶解后的Fe2O3会加速锅炉腐蚀,故需“还原”处理。
①锅炉被加速腐蚀的原因是______________________;
②浸泡液还原”处理时,Sn2+转化为Sn4+,则反应中氧化剂与还原剂的物质的量之比为______________________。
(3)“钝化”处理的目的是在锅炉表面形成Fe3O4保护膜,同时生成可直接参与大气循环的气体。
①反应的离子方程式为_________________________________;
②为检验锅炉“钝化”处理后是否形成致密的保护膜,可往锅炉内壁刷上硫酸铜溶液。若观察到______________________(填现象),则保护膜致密性欠佳。
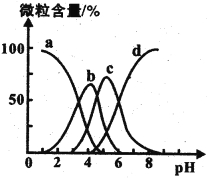
(4)柠檬酸(用H3R表示)可用作清除锅炉水垢的酸洗剂,溶液中H3R、H2R-、HR2-、R3-的含量与pH的关系如图所示。由此可推知,0.1 mol ·L-1 Na2HR溶液中各种阴离子浓度由大到小的排列顺序为______________________。
(5)用如图装置对锅炉用水(含Ca2+、Mg2+、HCO3-)进行预处理,可有效防止水垢形成。电解时,Ca2+形成沉淀的电极反应式为______________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用加热氯酸钾的方法制取少量氧气。
(1)请写出反应的化学方程式。_____
(2)现欲制取1.12L(标准状况)氧气,理论上需要消耗氯酸钾多少克?生成氯化钾物质的量多少?______、______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锰是一种重要的化工中间体,是锰行业研究的热点。一种以高硫锰矿(主要成分为含锰化合物及FeS)为原料制备硫酸锰的工艺流程如下:

已知:①“混合焙烧”后烧渣含MnSO4、Fe2O3及少量FeO、Al2O3、MgO。
②金属离子在水溶液中的平衡浓度与pH的关系如图所示(25℃):

③此实验条件下Mn2+开始沉淀的pH为7.54;离子浓度≤10-5mol·L-1时,离子沉淀完全。
请回答:
(1)传统工艺处理高硫锰矿时,不经“混合焙烧”,而是直接用H2SO4浸出,其缺点为___________。
(2)“氧化”时,发生反应的离子方程式为_________________________________。若省略“氧化”步骤,造成的后果是_________________________________。
(3)“中和除杂”时,生成沉淀的主要成分为______________________(填化学式)。
(4)“氟化除杂”时,若使溶液中的Mg2+和Ca2+沉淀完全,需维持c(F-)不低于___________。(已知:Ksp(MgF2)=6.4×10-10;Ksp(CaF2)=3.6×10-12)
(5)“碳化结晶”时,发生反应的离子方程式为______________________。
(6)“系列操作”指___________、过滤、洗涤、干燥
(7)用惰性电极电解MnSO4溶液可制备MnO2,电解过程中阳极的电极反应式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为TS(中文名![]() ,tián),TS的原子核外最外层电子数是7.下列说法不正确的是( )
,tián),TS的原子核外最外层电子数是7.下列说法不正确的是( )
A. TS是第七周期第ⅦA族元素 B. TS的同位素原子具有相同的电子数
C. TS在同族元素中非金属性最弱 D. 中子数为176的TS核素符号是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究含碳化合物的结构与性质,对生产、科研等具有重要意义
(1)冠醚是由多个二元醇分子之间失水形成的环状化合物。X、Y、Z是常见的三种冠醚,其结构如图所示。它们能与碱金属离子作用,并且随着环的大小不同而与不同金属离子作用。

①Li+计与X的空腔大小相近,恰好能进入到X的环内,且Li+与氧原子的一对孤电子对作用形成稳定结构W(如图)。
a.基态锂离子核外能量最高的电子所处能层符号为___________;
b.W中Li+与孤对电子之间的作用属于___________(选填字母标号)
A.离子键 B.共价键 C.配位键 D.氢键 E.以上都不是
②冠醚Y能与K+形成稳定结构,但不能与Li+计形成稳定结构。理由是___________。
③烯烃难溶于水,被KMnO4水溶液氧化的效果较差。若烯烃中溶人冠醚Z,氧化效果明显提升。
i.水分子中氧的杂化轨道的空间构型是___________,H-O键键角___________(填“>”“<”或“=”)109°28′
ii.已知:冠醚Z与KMnO4可以发生右图所示的变化。加入冠醚Z后,烯烃的氧化效果明显提升的原因是___________。
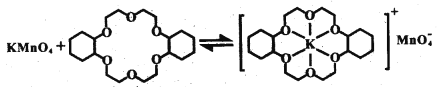
(2)甲烷是重要的清洁能源,其晶体结构如图所示,晶胞参数为anm。
①常温常压下不存在甲烷晶体。从微粒间相互作用的角度解释,其理由是___________;
②甲烷分子的配位数为___________;
③A分子中碳原子的坐标参数为(0,0,0),则B分子的碳原子的坐标参数为___________。
④甲烷晶体的密度为___________(g·cm-3)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个V升的密闭容器中放入2mol A(g)和1mol B(g),在一定条件下进行如下反应:3A(g)+B(g) ![]() nC(g) +2D(g),达平衡后A的浓度减小1/2,混合气体平均相对分子质量增大1/8,则该反应方程式中n的值是
nC(g) +2D(g),达平衡后A的浓度减小1/2,混合气体平均相对分子质量增大1/8,则该反应方程式中n的值是
A. 1 B. 2 C. 3 D. 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种将CO2和H2O转换为燃料H2、CO及CH4的装置如图所示(电解质溶液为稀H2SO4)。下列关于该装置的叙述错误的是

A. 该装置可将电能转化为化学能
B. 工作时,电极a周围溶液的pH增大
C. 电极b上生成CH4的电极反应式为CO2+8H++8e-===CH4+2H2O
D. 若电极b上只产生1 mol CO,则通过质子膜的H+数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com