
水溶液X中只可能溶有K+、Mg2+、Al3+、[Al(OH)4]-、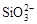 、
、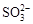 、
、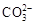 、
、 中的若干种离子。某同学对该溶液进行了如下实验:
中的若干种离子。某同学对该溶液进行了如下实验: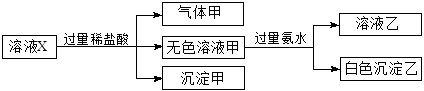
下列判断正确的是( )
| A.气体甲一定是纯净物 |
B.K+、[Al(OH)4]-和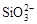 一定存在于溶液X中 一定存在于溶液X中 |
| C.沉淀甲是硅酸和硅酸镁的混合物 |
D.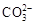 和 和 一定不存在于溶液X中 一定不存在于溶液X中 |
科目:高中化学 来源: 题型:单选题
下列反应的离子方程式书写正确的是
| A.向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至刚好沉淀完全:Ba2+ + 2OH- + NH4+ + H+ + SO42- = BaSO4↓+ NH3·H2O + H2O |
| B.碳酸钙溶于醋酸:CaCO3 + 2H+ =Ca2+ + CO2↑+ H2O |
| C.向硅酸钠溶液中通入过量的CO2:SiO32-+ CO2 + H2O= H2SiO3↓+ CO32- |
| D.澄清石灰水与过量小苏打溶液混合:Ca2+ + OH- + HCO3-="=" CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:(1)Al(OH)3的电离方程式为:AlO2-+H++H2O Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH-
(2)无水AlCl3晶体的沸点为182.9℃,溶于水的电离方程式为:AlCl3=Al3++3Cl-
(3)PbSO4难溶于水,易溶于醋酸钠溶液,反应的化学方程式为:
PbSO4+2CH3COONa=Na2SO4+(CH3COO)2Pb
则下列关于Al(OH)3、AlCl3和(CH3COO)2Pb的说法中正确的是
| A.均为强电解质 | B.均为弱电解质 |
| C.均为离子化合物 | D.均为共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列判断正确的是 ( )
①Ca(OH)2微溶于水,所以Ca(OH)2是弱电解质;②强电解质溶液的导电能力可能比弱电解质导电能力弱;③液态氯化氢不导电,但它是电解质;④碳酸氢钠是弱酸的酸式盐,所以是弱电解质;⑤SO3溶于水后导电,所以SO3是电解质;⑥Cu能导电,但它不是化合物,所以Cu是非电解质
| A.②③ | B.②③⑥ | C.①④⑤⑥ | D.②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,下列各组离子在给定条件下能大量共存的是
| A.在pH=1的溶液中:NH4+、K+、Ba2+、Cl- |
| B.在滴加石蕊试液显红色的溶液中:K+、NH4+、CO32-、SO42- |
| C.有NO3-存在的溶液中:H+、Ba2+、Cl-、SO32- |
| D.在c (H+)=1.0×10-3mol·L-1的溶液中:Na+、K+、SO42-、[Al(OH)4]一 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列各组离子中,因发生氧化还原反应而不能大量共存的是
| A.K+、H+、I-、MnO4- | B.Fe3+、Fe2+、SO42-、NO3- |
| C.Al3+、Na+、SO42-、CO32- | D.Fe3+、H+、SO42-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
能正确表示下列反应的离子方程式的是( )
| A.硫酸铝溶液中加入过量氨水 Al3++3OH-=Al(OH)3↓ |
| B.碳酸钠溶液中加入澄清石灰水 Ca(OH)2+ CO32-=CaCO3↓+2OH- |
| C.冷的氢氧化钠溶液中通入氯气 Cl2+2OH-=ClO-+Cl-+H2O |
| D.稀硫酸中加入铁粉 2Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com