
【题目】短周期主族元素X、Y、Z、W、R在元素周期表中的相对位置如图所示,其中R元素的常见单质为气体,下列判断不正确的是( )

A.原子半径:Z>X> Y
B.非金属性:R>W> Z
C.X、Z对应的含氧酸均为强酸
D.Y的最简单氢化物的沸点比X的高
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 用途广泛。请回答下列问题:
用途广泛。请回答下列问题:
(1)常温时,![]()
![]() 溶液的
溶液的![]() 。
。
则溶液中![]() ______c
______c![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() ;
;![]() ______
______![]() 填数值
填数值![]() 。
。
(2)![]() 时,
时,![]()
![]() 溶液的pH小于3,分析导致pH随温度变化的原因是__________________________________________
溶液的pH小于3,分析导致pH随温度变化的原因是__________________________________________![]() 用离子方程式并结合文字叙述回答
用离子方程式并结合文字叙述回答![]() 。
。
(3)常温时,向100mL![]()
![]() 溶液中滴加
溶液中滴加![]() NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示。向
NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示。向![]() 溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为_________________。
溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为_________________。

(4)浓度均为![]() 溶液和
溶液和![]() 溶液,其中______溶液
溶液,其中______溶液![]() 大。
大。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素X、Y均为短周期元素,X元素的一种核素常用于测文物的年代,Y元素原子半径是所有原子中最小的,元素X、Y可形成两种常见化合物M和N,已知M可以使高锰酸钾酸性溶液褪色,M分子中所含X元素的质量是Y元素质量的6倍,且M的相对分子质量为56。N是一种常用溶剂,它的实验式XY。回答下列问题:
(1)符合条件的M的有 ______种。
(2)任意写一种不带支链的M的结构简式__________。
(3)若在N与液溴的混合液中加入铁粉可以发生反应(在如图装置a容器中反应),则:
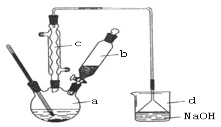
①写出a容器中发生的所有反应的化学方程式:_____________。
②d容器中NaOH溶液的作用是_____________。
(4)在碘水中加入N振荡静置后的现象是__________。
(5)等质量M、N完全燃烧时消耗O2的物质的量较多的是________(填“M”或“N”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有短周期主族元素X、Y、Z、R、T,R原子的最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Y与T同主族。五种元素原子半径与原子序数之间的关系如图所示。下列推断正确的是( )
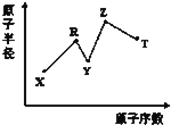
A. 离子半径:Y<Z
B. 氢化物的沸点:Y<T
C. 最高价氧化物对应水化物的酸性:T<R
D. 由X、Y、Z、R四种元素组成的常见化合物中含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼金属铝。下列说法错误的是( )
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
A. ①中还需要进行过滤操作,滤渣为二氧化硅
B. a、b中铝元素的存在形式不同
C. ③中需要通入过量的氨气
D. ④进行的操作是加热,而且d一定是氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由铜、铁和硫酸铜溶液组成的原电池中,作正极的是_______________(填化学式),正极的电极反应式为____________________________;作负极的是____________________(填化学式),电子由___________________(填“正”或“负”,下同)极经导线移向________________极,总反应的离子方程式为_________________________。若以反应![]() 来设计原电池,则电池的负极材料是____________________________(填化学式,下同),电解质溶液为________________________溶液。
来设计原电池,则电池的负极材料是____________________________(填化学式,下同),电解质溶液为________________________溶液。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.3 mol·L-1硫酸溶液480 mL。根据这种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液需要的是____ (填序号),配制上述溶液还需用到的玻璃仪器是____(填仪器名称)。
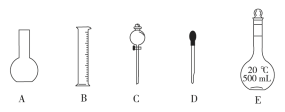
(2)下列操作中,是容量瓶所具备的功能有__________。
A.配制一定体积准确浓度的标准溶液 B.贮存溶液 C.测量容量瓶规格以下的任意体积的液体 D.稀释某一浓度的溶液 E.量取一定体积的液体 F.用来加热溶解固体溶质
(3)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为__________mL(计算结果保留一位小数)。如果实验室有10 mL、15 mL、20 mL量筒,应选用__________mL的量筒最好。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是:_________。
(4)下列操作会使配制的硫酸溶液浓度偏低的是__________。
A.俯视刻度线定容 B.选用的容量瓶内有少量蒸馏水 C.定容摇匀后,液面下降,又加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。一定条件下,向体积为1 L的恒容密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中正确的是 ( )
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。一定条件下,向体积为1 L的恒容密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中正确的是 ( )
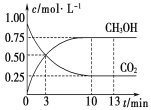
A. 3min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
B. 从反应开始到平衡,H2的平均反应速率v(H2)=0.225 mol·L-1·min-1
C. 13min时,向容器中充入2 mol氦气,该反应的化学反应速率增加
D. 13min时,向容器中充入2 mol氦气,CO2的转化率增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用下图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中,正确的是
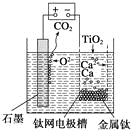
A. 由TiO2制得1 mol金属Ti,理论上外电路转移2 mol电子
B. 阳极的电极反应式为C+2O2--4e-===CO2↑
C. 在制备金属钛前后,整套装置中CaO的总量减少
D. 若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com