
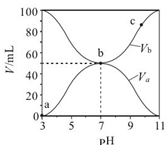
| A. | Ka(HA)=10-6 mol•L-1 | |
| B. | b 点时,c(B+)=c(A-)=c(H+)=c(OH-) | |
| C. | c 点时,$\frac{c({A}^{-})}{c(O{H}^{-})•c(HA)}$随温度升高而减小 | |
| D. | a→c 过程中水的电离程度始终增大 |
分析 A、由图可知 0.1mol•L-1HA 溶液pH=3,由 HA?H++A-代入Ka的表达式求解;
B、b点是两者等体积混合溶液呈中性;
C、c 点时,$\frac{c({A}^{-})}{c(O{H}^{-})•c(HA)}$=$\frac{1}{{K}_{h}}$,水解平衡常数Kh只与温度有关.
D、a→b是酸过量和b→c 是碱过量两过程中水的电离程受抑制,b点是弱酸弱碱盐水解对水的电离起促进作用.
解答 解:A、由图可知 0.1mol•L-1HA 溶液pH=3,由 HA?H++A-可知:Ka=$\frac{1{0}^{-3}×1{0}^{-3}}{0.1}$=10-5 mol•L-1,故A错误;
B、b点是两者等体积混合溶液呈中性,所以离子浓度的大小为:c(B+)=c(A-)>c(H+)=c(OH-),故B错误;
C、c 点时,$\frac{c({A}^{-})}{c(O{H}^{-})•c(HA)}$=$\frac{1}{{K}_{h}}$,水解平衡常数Kh只与温度有关,温度升高,Kh增大,$\frac{1}{{K}_{h}}$减小,$\frac{c({A}^{-})}{c(O{H}^{-})•c(HA)}$减小,故C正确.
D、a→b是酸过量和b→c 是碱过量两过程中水的电离程受抑制,b点是弱酸弱碱盐水解对水的电离起促进作用,所以a→c 过程中水的电离程度先增大后减小,故D错误;
故选C.
点评 本题考查酸碱混合离子的浓度关系,明确信息中pH及离子的关系来判断酸碱的强弱是解答本题的关键,并熟悉电离、盐类水解等知识来解答,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na与Na2SO4在灼烧时火焰颜色相同 | |
| B. | 焰色反应实验中常用稀盐酸洗涤金属丝 | |
| C. | 可以用焰色反应来区别NaCl和KCl | |
| D. | 观察K2CO3的焰色应透过红色的玻璃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500mL 2mol•L-1MgCl2溶液 | B. | 500mL 2.5mol•L-1NaCl溶液 | ||
| C. | 300mL 2.5mol•L-1CaCl2溶液 | D. | 250mL 1mol•L-1AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光照甲烷和氯气的混合气体,混合气体颜色变浅;乙烯能使溴水褪色 | |
| B. | 乙烷在氧气中燃烧;乙烯在氧气中燃烧 | |
| C. | 乙烯能使溴水褪色;乙烯能使酸性高锰酸钾溶液褪色 | |
| D. | 工业上由乙烯和水反应生成乙醇;乙烯能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盛放NaOH溶液的试剂瓶用磨口玻璃塞 | |
| B. | 氢氟酸保存在塑料瓶中 | |
| C. | 过氧化钠保存在广口瓶中 | |
| D. | 浓盐酸保存在细口试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成分 | WO3 W2O5 WO2 W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com