
科目:高中化学 来源: 题型:



| ||
| ||
 2BO3,在一个固定容积为2L的密闭容器中充入0.20mol的BO2和0.10mol的O2,半分钟后达到平衡,测得容器中含BO3为0.18mol,则v(o2 )=
2BO3,在一个固定容积为2L的密闭容器中充入0.20mol的BO2和0.10mol的O2,半分钟后达到平衡,测得容器中含BO3为0.18mol,则v(o2 )=查看答案和解析>>
科目:高中化学 来源:宁夏自治区模拟题 题型:推断题

(1)写出F的电子式____________。
(2)气体H有毒,可用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:________________。
(3)加热E的水溶液后并灼烧,最终得到的固体为____________, 原因为_______________, ____________。(用化学反应方程式来表示)
(4)室温下,向F的水溶液中加入等体积等浓度的盐酸反应后所得溶液的PH>7,则此溶液中离子浓度由小到大的顺序为:_______________。
(5)将气体H放在空气中充分燃烧可得到气体氧化物BO2,BO2可与氧气继续反应:2BO2+O2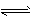 2BO3,在一个固定容积为2L的密闭容器中充入0.20 mol的BO2和0.10mol的O2,半分钟后达到平衡,测得容器中含BO3为0.18mol,则
2BO3,在一个固定容积为2L的密闭容器中充入0.20 mol的BO2和0.10mol的O2,半分钟后达到平衡,测得容器中含BO3为0.18mol,则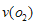 = ________ mol·L-1·min-1。若继续通入0.20mol BO2和0.10mol O2,再次达到新平衡后,BO3的物质的量介于__________之间。
= ________ mol·L-1·min-1。若继续通入0.20mol BO2和0.10mol O2,再次达到新平衡后,BO3的物质的量介于__________之间。
查看答案和解析>>
科目:高中化学 来源:湖北省模拟题 题型:推断题

(1)写出F的电子式____________。
(2)气体H有毒,可用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:________________。
(3)加热E的水溶液后并灼烧,最终得到的固体为____________, 原因为_______________, ____________。(用化学反应方程式来表示)
(4)室温下,向F的水溶液中加入等体积等浓度的盐酸反应后所得溶液的PH>7,则此溶液中离子浓度由小到大的顺序为:_______________。
(5)将气体H放在空气中充分燃烧可得到气体氧化物BO2,BO2可与氧气继续反应:2BO2+O2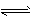 2BO3,在一个固定容积为2L的密闭容器中充入0.20 mol的BO2和0.10mol的O2,半分钟后达到平衡,测得容器中含BO3为0.18mol,则
2BO3,在一个固定容积为2L的密闭容器中充入0.20 mol的BO2和0.10mol的O2,半分钟后达到平衡,测得容器中含BO3为0.18mol,则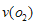 = ________ mol·L-1·min-1。若继续通入0.20mol BO2和0.10mol O2,再次达到新平衡后,BO3的物质的量介于__________之间。
= ________ mol·L-1·min-1。若继续通入0.20mol BO2和0.10mol O2,再次达到新平衡后,BO3的物质的量介于__________之间。
查看答案和解析>>
科目:高中化学 来源:福建省月考题 题型:推断题

(1)写出F的电子式____________。
(2)气体H有毒,可用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:________________。
(3)加热E的水溶液后并灼烧,最终得到的固体为____________, 原因为_______________, ____________。(用化学反应方程式来表示)
(4)室温下,向F的水溶液中加入等体积等浓度的盐酸反应后所得溶液的PH>7,则此溶液中离子浓度由小到大的顺序为:_______________。
(5)将气体H放在空气中充分燃烧可得到气体氧化物BO2,BO2可与氧气继续反应:2BO2+O2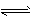 2BO3,在一个固定容积为2L的密闭容器中充入0.20 mol的BO2和0.10mol的O2,半分钟后达到平衡,测得容器中含BO3为0.18mol,则
2BO3,在一个固定容积为2L的密闭容器中充入0.20 mol的BO2和0.10mol的O2,半分钟后达到平衡,测得容器中含BO3为0.18mol,则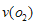 = ________ mol·L-1·min-1。若继续通入0.20mol BO2和0.10mol O2,再次达到新平衡后,BO3的物质的量介于__________之间。
= ________ mol·L-1·min-1。若继续通入0.20mol BO2和0.10mol O2,再次达到新平衡后,BO3的物质的量介于__________之间。
查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题
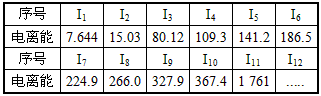
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com