



科目:高中化学 来源:不详 题型:实验题
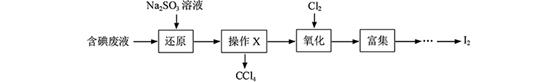
 I2+5SO42—+H2O
I2+5SO42—+H2O查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 取等物质的量的两种金属单质X、Y,分别与足量的盐酸反应 | X产生氢气的体积比Y多 | 金属性:X>Y |
| B | 等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 | HA放出的氢气多且反应速率快 | HA酸性比HB强 |
| C | 在CuSO4溶液中加入KI溶液,再加入苯,振荡 | 有白色沉淀生成,苯层呈紫色 | 白色沉淀可能为CuI |
| D | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
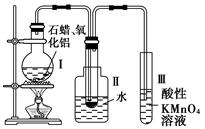
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.“中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须干燥或润洗后方可使用 |
| B.除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 |
| C.在硫酸镁溶液中加入氢氧化钠可以得到氢氧化镁沉淀 |
| D.将Mg(OH)2沉淀转入蒸发皿中,加足量稀盐酸,加热蒸干得无水MgCl2固体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 序号 | 实验内容 | 实验目的 |
| A | 用石墨电极电解Mg(NO3)2、Cu( NO3)2的混合液 | 比较确定铜和镁的金属活动性强弱 |
| B | 测同温同浓度Na2CO3和Na2SiO3水溶液的pH | 确定碳和硅两元素非金属性强弱 |
| C | 室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| D | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.称量样品→加热→冷却→称量CuO |
| B.称量样品→加热→冷却→称量Cu(NO3)2 |
| C.称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量 |
| D.称量样品→加NaOH→过滤→加热→冷却→称量CuO |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用无水乙醇提取碘水中的碘单质 |
| B.加入稀HNO3和BaCl2溶液产生白色沉淀的溶液中一定含SO42- |
| C.可用FeCl3溶液一次性鉴别CCl4、苯酚溶液、NaI溶液和NaCl溶液 |
| D.玻璃棒在配制0.1mol/L NaCl溶液与粗盐提纯的实验中所起的作用相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com