
����Ŀ�����������ѧ��Ҷ���쵼һ���о�С��ɹ������ȫ����ȷ��ʱ�ӣ�����������һ�롣����һ����ԭ���ӣ����ԭ����Ȫ��ȷ�ö࣬���ƽ��ɴ��ٽ���ͬ�ĵ�Ѷ����ķ�չ����ʹȫ����صĴ�ֻ������ø�Ϊȷ��������ȡ����Ԫ�����ڱ��е�λ�ã��ƶ��������ݣ�
��1����Ԫ������________�����������������ǽ�������Ԫ�أ������Աȸ�Ԫ��________������ǿ����������������ԭ�ӵĺ���������Ϊ________��ԭ�Ӻ�����________�����Ӳ㣬��ԭ�ӽṹʾ��ͼΪ��___________����ԭ�Ӱ뾶___________þ����������������С������������������蘆�ԭ�Ӻ����________����ӣ�����������Ϊ___________��
��2�����ˮ����ҷ�Ӧ���ų�___________ɫ���壬ͬʱʹ������ɫʯ����Һ����Һ��___________ɫ����Ϊ___________��д����ѧ����ʽ����
��3��̼������________ɫ��ĩ�������ᷴӦ�����ӷ���ʽΪ___________��
���𰸡���1������ ǿ 38 5  ���� 6 1
���� 6 1
��2���� �� 2Cs+2H2O=2CsOH+H2��
��3���� SrCO3+2H+=Sr2��+CO2��+H2O
������������ԭ�Ӻ�������Ų��Ĺ��ɣ����Ԫ�����ڱ���֪ʶ��֪Srλ��Ԫ�����ڱ��ĵ������ڵ���A�塢Csλ�ڵ������ڵ���A�塣Cs���м�ǿ�Ľ����ԣ���ˮ��Ӧ����������������藍�2Cs+2H2O=2CsOH+H2����̼������������ˮ�İ�ɫ��ĩ�����������ᣬ�����ӷ���ʽΪ��SrCO3+2H+=Sr2��+CO2��+H2O


 ��ҵ����ϵ�д�
��ҵ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ��Ӧ�ù㷺�Ĺ������Ϲ�̽�,��ϳ�·������(�����Լ��Ͳ�������ȥ)

��֪:I.
II.![]()
��ش���������
��1��A��������������������Ϊ______________________��
��2����Ȳ������X�ӳ�����E��E�ĺ˴Ź�������Ϊ�����,�ҷ������Ϊ3:2:1,E�ܷ���ˮ�ⷴӦ,��E�Ľṹ��ʽΪ_____________________��
��3��F��G���������Լ���_____________________________��
��4��C���ʲ��ܷ����ķ�Ӧ����Ϊ_____________(����ĸ���)��
a.�Ӿ۷�Ӧ b.���۷�Ӧ c.������Ӧ d. ��ԭ��Ӧ
��5��B��Ag(NH3)2OH��Ӧ�Ļ�ѧ����ʽΪ:__________________________��
��6����C������ͬ�������Һ��б�����ͬ���칹��_____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪AԪ��ԭ�ӵĺ˵��������BԪ��ԭ�ӵĺ˵������������Ԫ�ص�ԭ�Ӿ�����ͬ��Ŀ�ĵ��Ӳ㣬AԪ��ԭ������������ΪBԪ�ص�������AԪ��ԭ��M�������ΪK���������3����CԪ��ԭ�ӵĺ˵�����ǵ��Ӳ�����4������������Ϊ������������6������������пհף�
��1��A��ԭ�ӽṹʾ��ͼΪ____________��AԪ�ص�����Ϊ____________��
��2��B��ԭ�ӽṹʾ��ͼΪ____________��BԪ�ص�����Ϊ____________��
��3��C�����ӽṹʾ��ͼΪ____________��CԪ�ص�����Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ֱ�ͨ���±�������Һ��װ���Թܣ������������ԣ����ʵ�鱨���¼��ʵ��������ȷ���ǣ� ��
ʯ����Һ | Ʒ����Һ | ����������Һ | ��ˮ | |
A | ��ɫ | ��ɫ | ���ɫ���� | ��ɫ |
B | ��ɫ | ��ɫ | ��ɫ���� | ��ɫ |
C | ��ɫ | ��ɫ | ���ɫ���� | ����ɫ |
D | ��ɫ | ��ɫ | ���ɫ���� | ����ɫ |
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaH�е���Ԫ��Ϊ��1�ۣ������������������Ӧ�Ļ�ѧ����ʽ��NaH+H2O�TNaOH+H2����������˵����ȷ���ǣ� ��
A.NaOH����������
B.��1molNaH������Ӧʱ���÷�Ӧת�Ƶ��ӵ����ʵ���Ϊ2mol
C.NaHΪ��ԭ��
D.H2O���ǻ�ԭ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ���ͭ��CuCl����һ�ְ�ɫ��ĩ��������ˮ���Ҵ�����״���·е���78.2�棩��ϡ���ᣬ�۵�422�棬�е�1366�棬�ڿ�����Ѹ�ٱ���������ɫ���������л��ϳɹ�ҵ�еĴ������Դ���ˮ�����Ȼ��ơ�����þ�����ʣ���Cu��ϡ���ᡢSO2��Ϊԭ�Ϻϳ�CuCl�Ĺ����������£�
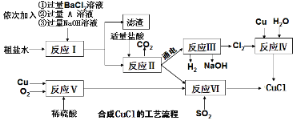
��1��A��Һ�����ʵĻ�ѧʽ��__________ ��
��2��д����ӦV�Ļ�ѧ����ʽ _______________ ��
��3����ӦVI�Ļ�ѧ����ʽ�ǣ�2NaCl+2CuSO4+SO2+2H2O=2CuCl��+2H2SO4+Na2SO4����Ӧ�л��ϼ����ߵ�Ԫ����___��
��4���������п�ѭ�����õ�������NaOH��_____��
��5����ӦVI���˵õ���CuCl����������ˮ�Ҵ�ϴ�ӳ���������ո��������70�����2Сʱ����ȴ�ܷ��װ���ò�Ʒ����ո����Ŀ����_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������(�Ҷ���)��������Ȼ���ֲ���У���һ�����ᡣ��������κͼ���������ˮ���������������ˮ�����ᾧ��(H2C2O4��2H2O)��ɫ���۵�Ϊ101�棬������ˮ����������ˮ��������170�����Ϸֽ⡣�ش��������⣺
��1������ͬѧ������ͼ��ʾ��װ�ã�ͨ��ʵ�������ᾧ��ķֽ���װ��A���Թܿ���������б��ԭ����__________��װ��C�пɹ۲쵽������ð��������ʯ��ˮ����ǣ��ɴ˿�֪���ᾧ��ֽ�IJ�������______��װ��B����Ҫ������______________________��

��2������ͬѧ��Ϊ���ᾧ��ֽ�IJ����л����ܺ���CO��Ϊ������֤��ѡ�ü���ʵ���е�װ��A��B����ͼ��ʾ�IJ���װ�ý���ʵ�顣

������ͬѧ��ʵ��װ���У��������ӵ�˳��ΪA��B��F��D��G��H��D��I������װ��H��ʢ�е�������_______����һ��ʹ��װ��D��������___________��
����֤�����ᾧ��ֽ��������CO��������________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������(K2FeO4�������Ͷ��ˮ���������������������£�

�ش��������⣺
(1)��Ӧ��Ӧ���¶Ƚϵ͵�����½��У����¶Ƚϸ�ʱNaOH��Cl2��Ӧ����NaClO3��д���¶Ƚϸ�ʱ��Ӧ�����ӷ���ʽ____________��
(2)����ҺI�м���NaOH�����Ŀ����_______������ĸ����
A���뷴ӦҺI�й�����Cl2������Ӧ�����ɸ����NaClO
B��NaOH�����ܽ�ʱ��ų��϶����������������߷�Ӧ����
C��Ϊ��һ����Ӧ�ṩ���ԵĻ���
D.ʹNaClO3ת��ΪNaClO
(3)��Ӧ���¶ȡ�ԭ�ϵ�Ũ�Ⱥ���ȶԸ�����صIJ��ʶ���Ӱ�졣ͼ1Ϊ��ͬ���¶��£���ͬ����Ũ�ȵ�Fe(NO3)3��K2FeO4�����ʵ�Ӱ�죻ͼ2Ϊһ���¶��£�Fe(NO3)3����Ũ�����ʱ��NaClOŨ�ȶ�K2FeO4�������ʵ�Ӱ�졣

��ҵ����������¶�Ϊ_______����ʱFe(NO3)3��NaClO������Һ���������Ũ��֮��Ϊ_____��
(4)��Ӧ���е����ӷ�Ӧ����ʽΪ_________________����Һ���м��뱥��KOH�õ�ʪ��Ʒ��ԭ����__________________��
(5)���������Ϊˮ������������ˮ��Ӧ�����ӷ�Ӧ�ǣ�4FeO42-+l0H2O=4Fe(OH)3�����壩ʮ3O2��+8OH-��������Ϊˮ��������ԭ���ǣ���_______________����_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.���ʯ��ʯī��Ϊͬλ��B.��������ϩ��Ϊͬ���칹��
C.16O��18O��Ϊͬλ��D.H2O��D2O��Ϊͬ��������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com