
【题目】如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)
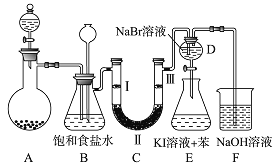
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的离子反应方程式为:_____________.装置 B 中饱和食盐水的作用是_________________;
若C处发生了堵塞,则B中的现象为__________________.
(2)装置 C 的实验目的是验证氯气是否具有漂白性,为此 C 中Ⅰ、Ⅱ、Ⅲ应该依次放入____(填编号)
① | ② | ③ | ④ | |
I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为______色,说明________________;打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是__________________;
(4)如果将二氧化锰与足量的浓盐酸混合加热,若有17.4g 的 MnO2 被还原,则被氧化的 HCl 的质量为_____.
(5)向 Na2CO3 溶液中通入氯气,可制得某种生产和生活中常用的漂白液,同时有 NaHCO3 生成,该反应的化学方程式是______.
【答案】MnO2+4H++2Cl![]() Mn2++Cl2↑+ 2H2O除去Cl2中的HCl长颈漏斗中液面上升,形成水柱,锥形瓶内液面下降④黄氯气的氧化性强于溴E中溶液分为两层,上层(苯层)为紫红色,(下层几乎无色)7.3g2Na2CO3+Cl2+H2O=2NaHCO3+NaCl+NaClO
Mn2++Cl2↑+ 2H2O除去Cl2中的HCl长颈漏斗中液面上升,形成水柱,锥形瓶内液面下降④黄氯气的氧化性强于溴E中溶液分为两层,上层(苯层)为紫红色,(下层几乎无色)7.3g2Na2CO3+Cl2+H2O=2NaHCO3+NaCl+NaClO
【解析】
(1)制备Cl2选用的药品为固体二氧化锰和浓盐酸,离子反应方程式为:MnO2+4H++2Cl![]() Mn2++Cl2↑+ 2H2O;反应过程中氯化氢和水蒸气是氯气中 的杂质,装置B中饱和食盐水的作用是除去Cl2中的HCl;装置B同时也起到安全瓶的作用,监测实验进行时C中是否发生堵塞,发生堵塞时B中的压强增大,B中长颈漏斗中液面上升,形成水柱,锥形瓶内液面下降;(2)装置C的实验目的是验证Cl2是否具有漂白性,要验证干燥Cl2无漂白性,湿润的有色布条中,Cl2和水反应生成次氯酸具有漂白性,选项中①②③的Ⅱ中都是干燥剂,再通入湿润的有色布条不能验证Cl2的漂白性,所以C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,所以选④;(3)D中是NaBr,当向D中缓缓通入少量Cl2时,Cl2和NaBr反应生成溴单质,可以看到无色溶液逐渐变为黄;氧化还原反应中氧化剂的氧化性大于氧化产物,说明氯气的氧化性强于溴;打开活塞,将装置D中含溴单质的少量溶液加入含碘化钾和苯的装置E中,溴单质和碘化钾反应生成碘单质,碘单质溶于苯呈紫红色,振荡.观察到的现象是:E中溶液分为两层,上层(苯层)为紫红色;(4)17.4g 的 MnO2的物质的量为:
Mn2++Cl2↑+ 2H2O;反应过程中氯化氢和水蒸气是氯气中 的杂质,装置B中饱和食盐水的作用是除去Cl2中的HCl;装置B同时也起到安全瓶的作用,监测实验进行时C中是否发生堵塞,发生堵塞时B中的压强增大,B中长颈漏斗中液面上升,形成水柱,锥形瓶内液面下降;(2)装置C的实验目的是验证Cl2是否具有漂白性,要验证干燥Cl2无漂白性,湿润的有色布条中,Cl2和水反应生成次氯酸具有漂白性,选项中①②③的Ⅱ中都是干燥剂,再通入湿润的有色布条不能验证Cl2的漂白性,所以C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,所以选④;(3)D中是NaBr,当向D中缓缓通入少量Cl2时,Cl2和NaBr反应生成溴单质,可以看到无色溶液逐渐变为黄;氧化还原反应中氧化剂的氧化性大于氧化产物,说明氯气的氧化性强于溴;打开活塞,将装置D中含溴单质的少量溶液加入含碘化钾和苯的装置E中,溴单质和碘化钾反应生成碘单质,碘单质溶于苯呈紫红色,振荡.观察到的现象是:E中溶液分为两层,上层(苯层)为紫红色;(4)17.4g 的 MnO2的物质的量为:![]() ,根据离子反应方程式:MnO2+4H++2Cl
,根据离子反应方程式:MnO2+4H++2Cl![]() Mn2++Cl2↑+ 2H2O可知,反应中1mol MnO2能氧化2mol盐酸,故17.4g 的 MnO2 被还原,则被氧化的 HCl 的质量为:2
Mn2++Cl2↑+ 2H2O可知,反应中1mol MnO2能氧化2mol盐酸,故17.4g 的 MnO2 被还原,则被氧化的 HCl 的质量为:2![]() ;(5) 向 Na2CO3 溶液中通入Cl2,可制得某种生产和生活中常用的漂白液NaClO,同时有 NaHCO3 生成,根据氧化还原反应原理,还有氯化钠产生(氯元素化合价降),该反应的化学方程式是:2Na2CO3+Cl2+H2O=2NaHCO3+NaCl+NaClO。
;(5) 向 Na2CO3 溶液中通入Cl2,可制得某种生产和生活中常用的漂白液NaClO,同时有 NaHCO3 生成,根据氧化还原反应原理,还有氯化钠产生(氯元素化合价降),该反应的化学方程式是:2Na2CO3+Cl2+H2O=2NaHCO3+NaCl+NaClO。


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】在容积为1L的密闭容器中,充入1mol CO2和3mol H2,在温度500℃时发生反应:CO2(g)+ 3H2(g) ![]() CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图,下列说法不正确的是
CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图,下列说法不正确的是
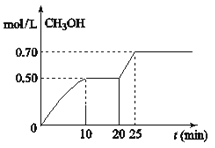
A.从反应开始到10分钟时,H2的平均反应速率v(H2)=0.15 mol/(L·min)
B.从20分钟到25分钟达到新的平衡,可能是增大压强
C.其它条件不变,将温度升到800℃,再次达平衡时平衡常数减小
D.从开始到25分钟,CO2的转化率是70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不能说明氯元素的非金属性比硫元素强的事实是
①HCl比H2S稳定 ②HClO氧化性比H2SO4强
③HClO4酸性比H2SO4强 ④Cl2能与H2S反应生成S
⑤氯原子最外层有7个电子,硫原子最外层有6个电子
A.②⑤ B.①② C.①②④ D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列物质按酸、碱、盐分类依次排列正确的是( )
A.硫酸、纯碱、石灰石
B.盐酸、烧碱、氯化钙
C.二氧化碳、氢氧化钙、碳酸钠
D.磷酸、氧化钙、醋酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 同温同压下,气体的物质的量与体积成反比。
B. 同温同体积时,气体的物质的量与压强成反比。
C. 同温同物质的量时,气体的压强与体积成正比。
D. 同压同体积时,气体的物质的量与温度成反比。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol/L NaCl溶液表示
A. 溶液里含有1mol NaCl B. 1mol NaCl溶解于1L水中
C. 58.5g NaCl溶于941.5g水中 D. 1L水溶液中含有NaCl 58.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制备气体常用的装置图,请回答下面相关问题:
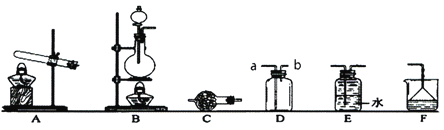
(1)①实验室用Na2SO3与浓硫酸反应制备SO2,应该选取_____装置(填写“A”或“B”),多余的SO2气体需要通过F装置吸收,装置中倒置的漏斗作用是_______。
②若采用D装置收集SO2气体,则进气管应该接______(填写“a”或“b”)
(2)①若选取A装置制备氨气,该反应的化学方程式为_________。
②干燥氨气时,常常在装置C中加入_______作干燥剂。
③有人说可以使用装置E收集氨气,你认为该观点是否正确?_______(填写“正确”或“不正确”) ,请说出原因______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com