
(12分) 诺贝尔物理学奖曾授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献。
(1)在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构。
则分子中B原子杂化轨道的类型为 ▲ ,同层分子间的主要作用为 ▲ 。
(2)K3[Fe(CN)6]晶体中含有的化学键类型为 ▲ ,Fe3+与CN-之间能够形成化学键的原因是 ▲ 。
(3)等物质的量的氧化物MO与SiC的电子总数相等,则M2+离子的核外电子排布式为 ▲ 。MO是优良的耐高温材料,其晶体结构与NaCl晶体相似,晶体中与每个M2+等距离且最近的几个O2-所围成的空间几何构型为 ▲ 。MO的熔点比CaO的高,原因是 ▲ 。
科目:高中化学 来源: 题型:
 (12分)瑞典皇家科学院10月6日宣布,美国科学家理查德-海克、根岸英一和日本科学家铃木彰因开发更有效的连接碳原子以构建复杂分子的方法获得2010年诺贝尔化学奖。通过实验发现,碳原子会和钯原子连接在一起,进行一系列化学反应。这一技术让化学家们能够精确有效地制造他们需要的各种复杂的含碳化合物。
(12分)瑞典皇家科学院10月6日宣布,美国科学家理查德-海克、根岸英一和日本科学家铃木彰因开发更有效的连接碳原子以构建复杂分子的方法获得2010年诺贝尔化学奖。通过实验发现,碳原子会和钯原子连接在一起,进行一系列化学反应。这一技术让化学家们能够精确有效地制造他们需要的各种复杂的含碳化合物。
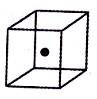
⑴碳原子可以形成多种单质,其中有一种为空间网状结构,右图立方体中心的“●”表示该晶体中的一个原子,请在该立方体的顶点上用“●”表示出与之紧邻的原子。
⑵C60形似足球,因此又名足球烯。其分子含有苯环单元的结构,则其碳原子采取 杂化成键。继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是 。
⑶工业酒精CH3OH的熔、沸点比CH4的熔、沸点比高,其主要原因是 。
⑷配合物Ni(CO)4常温为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于 晶体;基态Ni原子的电子排布式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com