
| ||
| ||
| 168×6.2g |
| 62 |
| 3.2g |
| 20g |


科目:高中化学 来源: 题型:
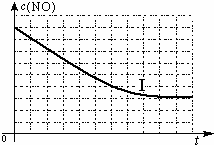
| ||
| 实验编号 | T/℃ | NO初始浓度/mol?L-1 | CO初始浓度/mol?L-1 | 催化剂的比表面积/m2?g-1 |
| Ⅰ | 280 | 1.2×10-3 | 5.8×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | HA物质的量浓度 (mol?L-1) | NaOH物质的量浓度 (mol?L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯和苯都能使溴水褪色,退色的原因相同 |
B、用KMnO4酸性溶液鉴别CH3CH═CHCH2OH和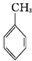 |
| C、乙炔既能使溴水退色,又能使酸性KMnO4溶液退色 |
| D、光照下2,2-二甲基丙烷与Br2反应其一溴取代物有两种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
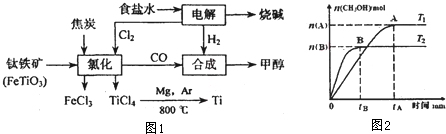
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
| B、由C(金刚石)→C(石墨)△H=-1.9KJ/mol 可知,金刚石比石墨稳定 |
| C、在101KPa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=+285.8KJ/mol |
| D、向纯水中加入硫酸氢钠,水的电离程度减小,Kw值不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com