
分析 (1)根据方程式可知反应消耗的A和B的物质的量相等进行计算;
(2)根据温度对平衡的影响分析,反应放热,降低温度平衡右移;
(3)由于温度不变,则平衡常数不变,与(1)相同,以此计算;
(4)设平衡时转化的M为xmol,由于温度不变,则平衡常数不变,与(1)相同,以此计算.
解答 解:(1)A转化的浓度为1mol/L×50%=0.5moL/L,则有:
A(g)+B(g)?C(g)+D(g);△H<0
初始:1mol/L 2.4mol/L 0 0
转化:0.6mol/L 0.6mol/L 0.6mol/L 0.6mol/L
平衡:0.4mol/L 1.8mol/L 0.6mol/L 0.6mol/L
B的转化率=$\frac{0.6mol/L}{2.4mol/L}$=25%,
故答案为:25%;
(2)反应放热,降低温度平衡右移,则B的转化率增大,故答案为:增大;
(3)根据相同温度时平衡常数不变求解,
A(g)+B(g)?C(g)+D(g);△H<0
初始:4mol/L amol/L 0 0
转化:2mol/L 2mol/L 2mol/L 2mol/L
平衡:2 mol/L (a-2)mol/L 2mol/L 2mol/L
由于温度不变,则平衡常数不变,与(1)相同,则有:$\frac{0.6mol/L×0.6mol/L}{0.4mol/L×1.8mol/L}$=$\frac{2mol/L×2mol/L}{2mol/L×(a-2)mol/L}$,解之得a=6,故答案为:6;
(4)设平衡时转化的M为xmol,
A(g)+B(g)?C(g)+D(g);△H<0
初始:bmol/L bmol/L 0 0
转化:xmol/L xmol/L xmol/L xmol/L
平衡:(b-x) mol/L (b-x)mol/L xmol/L xmol/L
由于温度不变,则平衡常数不变,与(1)相同,则有:$\frac{{x}^{2}}{(b-x)^{2}}$=$\frac{0.6mol/L×0.6mol/L}{0.4mol/L×1.8mol/L}$,则:x≈0.4b,故答案为:0.4b.
点评 本题考查化学平衡的计算,题目难度不大,做题时注意利用平衡常数计算.


 特高级教师点拨系列答案
特高级教师点拨系列答案 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:实验题
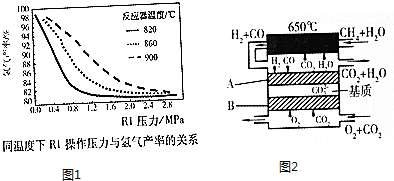
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉和淀粉酶混合后微热 | |
| B. | 用蘸有质量分数为75%的酒精棉花球擦皮肤 | |
| C. | 用紫外线光灯照射病房 | |
| D. | 用福尔马林浸动物标本 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入催化剂可以提高单位时间氨的产量 | |
| B. | 高压有利于氨的合成反应 | |
| C. | 500℃高温比室温更有利于合成氨的反应 | |
| D. | 恒温恒容下,在合成氨平衡体系中充入He,使压强增大,则平衡正向移动,NH3增多 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2(g)+2CO(g)═S(s)+2CO2(g)△H=(2Q1-2Q2+Q3) kJ•mol-1 | |
| B. | S(s)+2CO(g)═SO2(g)+2C(s)△H=(Q1-Q3) kJ•mol-1 | |
| C. | SO2(g)+2CO(g)═S(s)+2CO2(g)△H=(Q1-2Q2+Q3) kJ•mol-1 | |
| D. | SO2(g)+2CO(g)═S(s)+2CO2(g)△H=(2Q1-Q2+2Q3) kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CuO)(mol) | 0.080 | 0.060 | 0.040 | 0.020 | 0.020 | 0.020 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
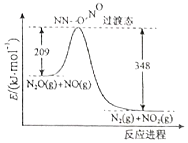 请完成下列问题
请完成下列问题| 物质 | H2(g) | Br2(g) | HBr(g) |
| 1mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | 200 | a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com