
 .
.
分析 元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大.Y元素原子最外层电子数与核外电子总数之比为3:4,最外层电子数只能为6,则原子总数为8,Y为O元素;M原子的质子数是Y原子的2倍,且M原子的最外层电子数与次外层电子数之比为3:4,次外层为8,则M为S元素;结合N-、Z+、X+的半径逐渐减小,化合物XN在常温下为气体,可判N为Cl元素,Z为Na元素,X为氢元素,据此回答下列问题.
解答 解:元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大.Y元素原子最外层电子数与核外电子总数之比为3:4,最外层电子数只能为6,则原子总数为8,Y为O元素;M原子的质子数是Y原子的2倍,则M为S元素;结合N-、Z+、X+的半径逐渐减小,化合物XN在常温下为气体,可判N为Cl元素,Z为Na元素,X为氢元素,
(1)X、Y、Z按1:1:1形成的化合物的化学式为NaClO,NaClO是离子化合物,由Na+离子和ClO-离子构成,NaClO的电子式为 ,故答案为:
,故答案为: ;
;
(2)由X、Y、Z、M、N中某些原子形成的18电子分子和18电子离子分别为H2O2、S2-,它们发生氧化还原反应的离子方程式为H2O2+S2-+2H+=S↓+2H2O,
故答案为:H2O2+S2-+2H+=S↓+2H2O;
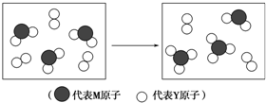
(3)由图可知,该转化过程为SO2与O2反应生成三氧化硫,反应化学方程式为:2SO2+O2 $?_{△}^{催化剂}$2SO3,
故答案为:2SO2+O2 $?_{△}^{催化剂}$2SO3.
点评 本题考查结构物质性质关系应用,难度不大,根据核外电子排布规律推断元素是解题关键,侧重对基础知识的巩固.


科目:高中化学 来源: 题型:选择题
| A. | 1mol/L乙酸溶液的pH值约为2 | |
| B. | 乙酸能与水以任何比例互溶 | |
| C. | 10mL1mol/L乙酸恰好与10mL1mol/LNaOH溶液完全反应 | |
| D. | 向CaCO3粉末中加入乙酸溶液有CO2气体生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
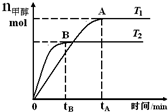 在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )
在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )| A. | CO合成甲醇的反应为吸热反应 | |
| B. | 处于A点的反应体系从T1变到T2,达到平衡时$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$ 增大 | |
| C. | 平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)c({H}_{2})}$ | |
| D. | 该反应在T1时的平衡常数比T2时的小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B60和C90都属于新型化合物 | B. | C60和N60属于同分异构体 | ||
| C. | B60、C60、C90、N60都只含共价键 | D. | B60、C60、C90、N60都属于烯烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都能与水反应生成相应的酸 | |
| B. | SiO2可用于制光导纤维,干冰可用于人工降雨 | |
| C. | SiO2的熔点比CO2高 | |
| D. | 都能与强碱溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com