
(07年重庆卷)(14分)脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源。
(1)硫化氢与 FeCl3 溶液反应生成单质硫,其离子方程式为 _______ 。
(2)用过量NaOH溶液吸收硫化氢后,以石墨作电极电解该溶液可回收硫、其电解总反应方程式(忽略氧的氧化还原)为 ____ ;该方法的优点是______ 。
(3)一定温度下1 mol NH4 HS固体在定容真空容器中可部分分解为硫化氢和氨气。
①当反应达平衡时p氨气×p硫化氢=a(Pa2),则容器中的总压为______ Pa;
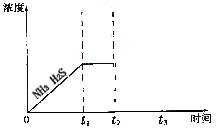
②题图是上述反应过程中生成物浓度随时间变化的示意图。若t2时增大氨气的浓度且在t3时反应再次达到平衡,请在图上画出t2时刻后氨气、硫化氢的浓度随时间的变化曲线。
答案:(1)2Fe2++H2S=S↓+2Fe2++2H+
(2)Na2S+2H2O![]() S↓+H2↑+2NaOH或S2++2H2O
S↓+H2↑+2NaOH或S2++2H2O![]() S↓+ H2↑+2OH-
S↓+ H2↑+2OH-
副产氢气,生成的NaOH可循环利用。
(3)①2![]()
②
解析:(1)因硫化氢与FeCl3溶液反应生成单质硫,即H2S表现还原性被氧化为单质硫,而FeCl3表现氧化性被还原为FeCl2,所以此反应的化学方程式为2FeCl3+H2S=2FeCl2+S↓+2HCl,其离子方程式为2Fe2++H2S=S↓+2Fe2++2H+。
(2)用过量NaOH溶液吸收硫化氢将得到Na2S溶液,用石墨电极电解此溶液时,阳极附近有S2-和OH-,其中S2-失电子发生氧化反应S2+![]() S↓+2e-,负极附近有H+和Na+,其中H+得电子发生还原反应2H++2e-=H2↑,因此电解的总方程式为Na2S+2H2O
S↓+2e-,负极附近有H+和Na+,其中H+得电子发生还原反应2H++2e-=H2↑,因此电解的总方程式为Na2S+2H2O![]() S↓+H2↑+2NaOH,其中生成的氢气可以作燃料或化工原料,生成的NaOH可以循环利用。
S↓+H2↑+2NaOH,其中生成的氢气可以作燃料或化工原料,生成的NaOH可以循环利用。
(3)因NH4HS(s)![]() NH3(g)+H2S(g),因此达到化学平衡时NH3和H2S的物质的量是相等的,根据阿夫加德罗定律可得出p氨气=p硫化氢=
NH3(g)+H2S(g),因此达到化学平衡时NH3和H2S的物质的量是相等的,根据阿夫加德罗定律可得出p氨气=p硫化氢=![]() p总,因p氨气×p硫化氢=a(Pa2),所以p总=2
p总,因p氨气×p硫化氢=a(Pa2),所以p总=2![]() Pa。
Pa。
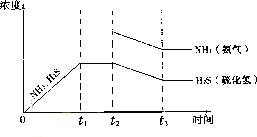
根据分解方程式和图示可知在达到平衡时NH3和H2S的平衡浓度相等,若在t2时刻增大NH3的浓度,在这一瞬间H2S的浓度并没有改变,但是由于NH3的浓度的增大将使平衡NH4HS(s)![]() NH3(g)+H2S(g)向右移动,致使NH3和H2S的浓度均减小,直至t3时刻再次达到平衡时不变,但是在新的平衡状态中NH3的浓度要比H2S的浓度大。所以图示为(见答案)。
NH3(g)+H2S(g)向右移动,致使NH3和H2S的浓度均减小,直至t3时刻再次达到平衡时不变,但是在新的平衡状态中NH3的浓度要比H2S的浓度大。所以图示为(见答案)。
高考考点:离子方程式的书写、电解方程式的书写、化学平衡的有关知识。
易错提醒:审题不清将第(1)题的离子方程式写为化学方程式;对电解硫化钠溶液时阴阳极上离子的放电顺序弄错;对于第(3)题忽略再次达到平衡时NH3的浓度比H2S的浓度大,而将图像中的二者画为一条直线。
备考提示:在电化学中书写电极反应式时,尤其是原电池的电极反应式必须注意电解质溶液的参与情况,例如各种燃料电池的电极反应式的书写。关于化学方程式的计算,因涉及的方程式比较多,因此在解答时必须分析各个方程式的量的关系,通过关系式法或元素守恒法进行解答。在备考复习针对电化学除掌握必要的基础知识外,应强化训练;针对化学计算则应加大力度强化训练,使学生形成良好的计算格式并培养学生各种计算能力。
对于化学平衡是中学化学中的重难点知识之一,也是历年高考试题的命题热点之一。在备考复习时应熟练掌握有关的基础知识和原理,同时针对这一部分应加大训练的力度,以形成各种解题能力。


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
(07年重庆卷)(14分)脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源。
(1)硫化氢与FeCl3溶液反应生成单质硫,其离子方程式为 ________ 。
(2)用过量NaOH溶液吸收硫化氢后,以石墨作电极电解该溶液可回收硫、其电解总反应方程式(忽略氧的氧化还原)为 _____ ;该方法的优点是_________ 。
(3)一定温度下1 mol NH4 HS固体在定容真空容器中可部分分解为硫化氢和氨气。
①当反应达平衡时p氨气×p硫化氢=a(Pa2),则容器中的总压为 _____ Pa;
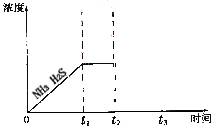
②题26图是上述反应过程中生成物浓度随时间变化的示意图。若t2时增大氨气的浓度且在t3时反应再次达到平衡,请在图上画出t2时刻后氨气、硫化氢的浓度随时间的变化曲线。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com