
【题目】下列关于研究物质性质的基本程序,排列顺序正确的是
a.观察物质的外观性质 b.实验和观察 c.解释及结论 d.预测物质的性质
A.bacd B.abcd C.adbc D.dabc
科目:高中化学 来源: 题型:
【题目】把氢氧化钠溶液和硫酸铜溶液加入某病人的尿液中,加热时如果发现有红色的沉淀产生,说明该尿液中含有( )
A. 醋酸 B. 酒精 C. 食盐 D. 葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德国重离子研究中心2010年2月19日宣布,由该中心人工合成的第ll2号化学元素从即日起获正式名称“Copemicium”,相应的元素符号为“Cn”。该元素的名称是为了纪念著名天文学家哥白尼而得名。该中心人工合成Cn的过程可表示为:7030Zn+20882Pb→277112Cn+10n。下列叙述中正确的是 ( )
A. 上述合成过程属于化学变化
B. Cn元素位于元素周期表的第七周期,是副族元素
C. Cn元素的相对原子质量为277
D. 277112Cn的原子核内质子数比中子数多53
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定温度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26。向浓度均为0.20mol/L的MgCl2和CaCl2混合溶液中逐滴加人Na3P04,先生成___________沉淀(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于10-5mol/L)时,溶液中的另一种金属阳离子的物质的量浓度c=____________mol/L。
(2)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
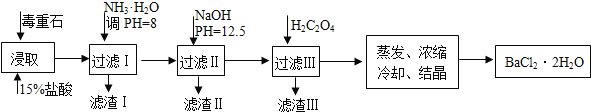
①毒重石用盐酸浸取前需充分研磨,目的是_____________________。
②加入NH3·H2O调节PH=8可除去_____________(填离子符号),滤渣II中含____________(填化学式)。加入H2C2O4时应避免过量,原因是_________________。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.7 |
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(3)已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100mL该条件下的CaSO4饱和溶液中加入400mL0.01mol/LNa2SO4溶液,下列叙述正确的是

A.溶液中析出CaSO4固体沉淀,最终溶液中c(SO42-)比原来的大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C.溶液中析出CaSO4固体沉淀.溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42-)比原来的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.常温下,pH=2的盐酸与硫酸的混合溶液中:![]()
B.某0.1 mol.L-l的NaHA溶液的pH=4,该溶液中:![]()
C.NaOH与CH3 COOH混合所得溶液中离子浓度不可能是:![]()
D.等浓度的Na2 C03溶液与NaHC03溶液等体积混合,所得溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的氯气通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是( )
A.与NaOH反应的氯气一定为0.3 mol
B.n(Na+):n(Cl-)可能为7:3
C.若反应中转移的电子为n mol,则0.15<n<0.25
D.n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com