
分析 将等物质的量的A、B混合于2L的密闭容器中,经5min后,测得D的浓度为0.5mol/L,生成的D为2L×0.5mol/L=1mol,则:
3A(g)+B(g)?xC(g)+2D(g)
起始量(mol):n n 0 0
变化量(mol):1.5 0.5 0.5x 1
5min时(mol):n-1.5 n-0.5 0.5x 1
由于5min时c(A):c(B)=3:5,则(n-1.5):(n-0.5)=3:5,解得n=3,据此解答.
解答 解:将等物质的量的A、B混合于2L的密闭容器中,经5min后,测得D的浓度为0.5mol/L,生成的D为2L×0.5mol/L=1mol,则:
3A(g)+B(g)?xC(g)+2D(g)
起始量(mol):n n 0 0
变化量(mol):1.5 0.5 0.5x 1
5min时(mol):n-1.5 n-0.5 0.5x 1
由于5min时c(A):c(B)=3:5,则(n-1.5):(n-0.5)=3:5,解得n=3,
(1)此时A的浓度c(A)=$\frac{(3-1.5)mol}{2L}$=0.75mol/L,反应开始前容器中的B的物质的量n(B)=3mol,故答案为:0.75mol/L;3mol;
(2)v(B)=$\frac{\frac{0.5mol}{2L}}{5min}$=0.05mol/(L•min),故答案为:0.05mol/(L•min);
(3)$\frac{\frac{0.5xmol}{2L}}{5min}$=0.1mol/(L•min),则x=2,故答案为:2.
点评 本题考查化学平衡计算,比较基础,注意掌握三段式解题法在化学平衡计算中应用.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:解答题

 ;
; ”结构的链状化合物共有7种;
”结构的链状化合物共有7种;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M-3aNA-b | B. | M-3aNA+b | C. | [(M÷NA)-3a-b] | D. | [M÷(3a-b)NA] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
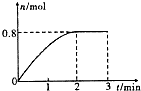 一定条件下,将3molA和l mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?C(g)+2D(s).2min末该反应达到平衡,生成D的物质的量随时间变化情况如图.下列判断正确的是( )
一定条件下,将3molA和l mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?C(g)+2D(s).2min末该反应达到平衡,生成D的物质的量随时间变化情况如图.下列判断正确的是( )| A. | 若混合气体的密度不再改变时,该反应不一定达到平衡状态 | |
| B. | 2 min后,加压会使正反应速率加快,逆反应速率变慢,平衡正向移动 | |
| C. | 反应过程中A和B的转化率之比为3:1 | |
| D. | 开始到平衡,用A表示该反应的化学反应速率为0.3mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-542.7 kJ•mol-1 | |
| B. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1059.3 kJ•mol-1 | |
| C. | N2H4(g)+N2O4(g)═N2(g)+2H2O(g)△H=-1076.7 kJ•mol-1 | |
| D. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1076.7 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +218kJ/mol | B. | -109kJ/mol | C. | 218kJ | D. | 109kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com