
如图所示装置实验,若X 轴表示流入阴极的电子的物质的量,则Y 轴可表示
①c(Ag+) ②a棒的质量 ③c(NO-3) ④b棒的质量 ⑤溶液的pH
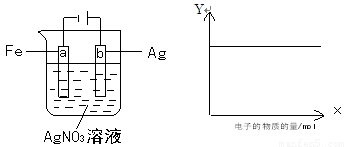
A ①③ B ③④ C ①②④ D ①③⑤
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:阅读理解

| BL |
| 22.4L/mol |
| Ag |
| 100g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
一、定性研究:
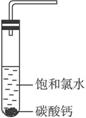
①在试管中加入过量的块状碳酸钙,再加入约20 mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生。
经检测,上述实验中产生的无色气体均为CO2。
请完成下列问题:
(1)反应后所得的溶液漂白性增强的原因是____________________________________。
(2)依据上述实验可推知,②的滤液中的溶质除CaCl2、HCIO外,还含有_________。
二、定量研究:
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150 mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加。
请完成下列问题:
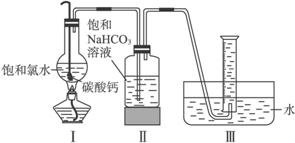
(3)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,最简单的方法是____________________________________________________。
(4)用改进后的装置进行上述实验,测得塑料网内的碳酸钙质量减少A g,总共收集到标准状况下的CO2气体B L,发现![]() 明显小于
明显小于![]() 。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是____________________________________________。
。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是____________________________________________。
(5)实验后发现,装置Ⅱ中的液体增多了,其原因是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一。2005年的《化学教育》报道了如下实验研究:
实验一、定性研究:
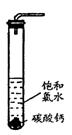 ①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生。
经检测,上述实验中产生的无色气体均为CO2。
请回答:
(1)反应后所得的溶液漂白性增强的原因
(2)写出步骤③中第一份及第三份滤液发生的离子方程式:
第一份:
第三份:
(3)依据上述实验可推知,②的滤液中的溶质除CaCl2、HClO外,还含有______ __ ___;
实验二、定量研究:
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加。
请回答:
 |
(4)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,最简单的方法是
(5)用改进后的装置进行上述实验,测得塑料网内的碳酸钙质量减少Ag,总共收集到标准状况下的CO2气体BL,发现![]() 明显小于
明显小于![]() 。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是____________
。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是____________
;
(6)实验后发现,装置Ⅱ中的液体增多了,其原因是_______________ _
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示装置实验,若X 轴表示流入阴极的电子的物质的量,则Y 轴可表示
①c(Ag+) ②a棒的质量 ③c(NO-3) ④b棒的质量 ⑤溶液的pH
A ①③ B③④ C ①②④ D ①③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com