
【题目】下列依据实验操作及现象得出的结论正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 向亚硫酸钠试样中滴入盐酸酸化的Ba(C1O)2 溶液 | 产生白色沉淀 | 试样已氧化变质 |
B | 向Co2O3中滴入浓盐酸 | 产生黄绿色气体 | 氧化性:Co2O3 > C12 |
C | 向待测液中依次滴入氯水和KSCN 溶液 | 溶液变为红色 | 待测液中含有Fe2+ |
D | 向NaHCO3溶液中滴加NaAlO2溶液 | 有白色沉淀和气体产生 | AlO2-与HCO3-发生了双水解反应 |
A. A B. B C. C D. D
【答案】B
【解析】A项,若试样没有变质,Ba(ClO)2具有强氧化性,可将Na2SO3氧化成Na2SO4,Na2SO4与Ba2+形成不溶于稀盐酸的BaSO4沉淀,错误;B项,Co2O3中滴入浓盐酸产生黄绿色气体,则浓盐酸被氧化成Cl2(Cl2为氧化产物),Co2O3为氧化剂,根据同一反应中氧化性:氧化剂![]() 氧化产物,氧化性:Co2O3
氧化产物,氧化性:Co2O3![]() Cl2,正确;C项,待测液中依次滴入氯水和KSCN溶液,溶液变为红色,待测液中可能只有Fe3+不含Fe2+,检验Fe2+应先加KSCN溶液无明显现象,再加氯水溶液变红,错误;D项,NaHCO3溶液中滴加NaAlO2溶液,发生反应:NaHCO3+NaAlO2+H2O=Na2CO3+Al(OH)3↓,只有白色沉淀,不是双水解反应,是“强制弱”的复分解反应,错误;答案选B。
Cl2,正确;C项,待测液中依次滴入氯水和KSCN溶液,溶液变为红色,待测液中可能只有Fe3+不含Fe2+,检验Fe2+应先加KSCN溶液无明显现象,再加氯水溶液变红,错误;D项,NaHCO3溶液中滴加NaAlO2溶液,发生反应:NaHCO3+NaAlO2+H2O=Na2CO3+Al(OH)3↓,只有白色沉淀,不是双水解反应,是“强制弱”的复分解反应,错误;答案选B。


 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源: 题型:
【题目】对于反应4NH3+5O2===4NO+6H2O,下列为4种不同情况下测得的反应速率,其中能表明该反应进行最快的是( )
A. v(NH3)=0.2 mol·L-1·s-1 B. v(O2)=14 mol·L-1·min-1
C. v(H2O)=0.25 mol·L-1·s-1 D. v(NO)=9 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水的离子积:25℃时Kw=1×10﹣14,100℃时Kw=1×10﹣12。试回答以下问题.
(1)25℃时,某Na2SO4溶液中c(SO42﹣)=5×10﹣4 molL﹣1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH﹣)=_________.
(2)在100℃时,测得某溶液pH=7,该溶液显_________(填“酸”、“碱”或“中”)性.
(3)将100℃温度下pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合,若所得混合液pH=2,则a:b=________.
(4)某温度时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数Kw=________。
①该温度下( T ℃),将100 mL 0.1 mol·L-1的稀H2SO4溶液与100 mL 0.4 mol·L-1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH=____________。
②该温度下(T ℃),1体积的稀硫酸和10体积的NaOH溶液混合后溶液呈中性,则稀硫酸的pH(pHa)与NaOH溶液的pH(pHb)的关系是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T ℃时,在0.5 L的密闭容器中,气体A与气体B反应生成气体C,反应过程中A、B、C的浓度变化如图所示。则下列结论正确的是

A. 10 s时反应生成了0.2 mol C
B. 该反应进行到10 s时,消耗了0.2 molA
C. 该反应的化学方程式为3A+B![]() 2C
2C
D. 10 s内用B表示的反应速率为0.01 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和铜都是日常生活中常见的金属,有着广泛的用途。请回答下列问题:
(1)铁在元素周期表中的位置_________。
(2)配合物Fe(CO)n常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)n晶体属于______(填晶体类型)。Fe(CO)n的中心原子价电子数与配体提供电子数之和为18,则n=______ 。Fe(CO)n在一定条件下发生反应:Fe(CO)n(s)![]() Fe(s)+ n CO(g)。已知反应过程中只断裂配位键,则该反应生成物中新形成的化学键类型为___________。
Fe(s)+ n CO(g)。已知反应过程中只断裂配位键,则该反应生成物中新形成的化学键类型为___________。
(3)K3[Fe(CN)6]溶液可用于检验________(填离子符号)。CN-中碳原子杂化轨道类型为_________,C、N、O三元素的第一电离能由大到小的顺序为_______(用元素符号表示)。
(4)铜晶体的晶胞如右图所示。
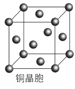
①基态铜原子的核外电子排布式为________________。
②每个铜原子周围距离最近的铜原子数目________。
(5)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如附图所示(黑点代表铜原子)。
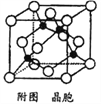
①该晶体的化学式为____________。
②已知该晶体的密度为g.cm-3,阿伏伽德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为_________pm(只写计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲苯(![]() )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(![]() )、苯甲酸(
)、苯甲酸(![]() )等产品。下表列出了有关物质的部分物理性质,请回答:
)等产品。下表列出了有关物质的部分物理性质,请回答:
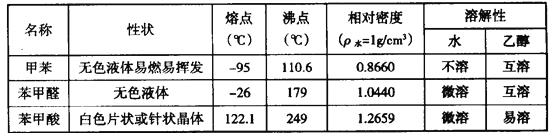
注:甲苯、苯甲醛、苯甲酸三者互溶; 酸性: 苯甲酸>醋酸
实验室可用如图装置模拟制备苯甲醛。实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸和2mL甲苯,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时。
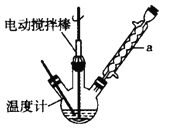
(1)装置a的名称是____ ____,主要作用是 。三颈瓶中发生反应的化学方程式为 ,此反应的原子利用率理论上可达 。
(2)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是________________。
(3)反应完毕后,反应混合液经过自然冷却至室温时,还应经过________、________(填操作名称)等操作,才能得到苯甲醛粗产品。
(4)实验中加入过量的过氧化氢并延长反应时间时,会使苯甲醛产品中产生较多的苯甲酸。
①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是_______(按步骤顺序填字母)。
a.对混合液进行分液 b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2 d.与适量碳酸氢钠溶液混合震荡
②若对实验①中获得的苯甲酸产品进行纯度测定,可称取1.200g产品,溶于100mL乙醇配成溶液,量取所得的乙醇溶液20.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000mol/L KOH标准液滴定,到达滴定终点时消耗KOH溶液18.00mL。产品中苯甲酸的质量分数为________。
③下列情况会使测定结果偏低的是__________(填字母)。
a.滴定终点时俯视读取耗碱量 b.KOH标准液长时间接触空气
c.配制KOH标准液时仰视定容 d.将酚酞指示剂换为甲基橙溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com