
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol—1)的变化。
CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol—1)的变化。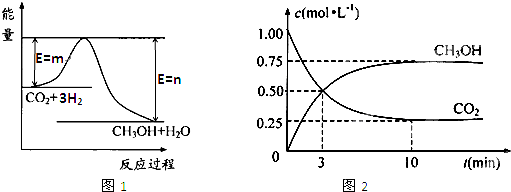
(1)写出该反应的热化学方程式 。
(2)关于该反应的下列说法中,正确的是 。
A.△H>0,△S>0 B.△H>0,△S<0 C.△H<0,△S<0 D.△H<0,△S>0
(3)该反应的平衡常数K的表达式为: 。
(4)温度降低,平衡常数K (填“增大”、 “不变”或“减小”)。
(5)为探究反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1 molCO2和3 molH2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v (H2)= 。
(6)下列措施中能使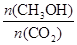 增大的有 。
增大的有 。
A.升高温度
B.加入催化剂
C.将H2O(g)从体系中分离
D.体积不变,充入He(g)使体系总压强增大
(1)CO2(g)+3H2(g) CH3OH(g)+H2O (g) △H=-(n-m)kJ?mol?1(2分)
CH3OH(g)+H2O (g) △H=-(n-m)kJ?mol?1(2分)
(2)C(1分) (3) (1分)
(1分)
(4)增大(1分) (5)0.225mol/(L·min)(1分) (6)C(1分)
解析试题分析:(1)该工业方法制取甲醇原理为二氧化碳与氢气反应生成甲醇和水,根据图像可知,反应物的总能量高于生成物的总能量,因此该反应是放热反应。反应热等于反应物的总能量和生成物总能量的差值,因此该反应的热化学方程式为CO2(g)+3H2(g) CH3OH(g)+H2O (g) △H=-(n-m)kJ?mol?1。
CH3OH(g)+H2O (g) △H=-(n-m)kJ?mol?1。
(2)由图1可知,反应物的总能量高于生成物的总能量,该反应为放热反应,即△H<0;由方程式可知,该反应正反应是气体的物质的量减小的反应,故正反应为熵减过程,即△S<0,所以答案选C。
(3)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据可逆反应可逆反应CO2(g)+3H2(g) CH3OH(g)+H2O (g)可知,该可逆反应的平衡常数K=
CH3OH(g)+H2O (g)可知,该可逆反应的平衡常数K= 。
。
(4)该反应正反应是放热反应,降低温度平衡向正反应移动,平衡常数增大。
(5)由图2可知,10min达平衡时甲醇的浓度变化量为0.75mol/L,所以v(CH3OH)= =0.075mol?L-1?min-1。又因为反应速率之比等于化学计量数之比,因此v(H2)=3v(CH3OH)=0.075mol?L-1?min-1×3=0.225mol?L-1?min-1。
=0.075mol?L-1?min-1。又因为反应速率之比等于化学计量数之比,因此v(H2)=3v(CH3OH)=0.075mol?L-1?min-1×3=0.225mol?L-1?min-1。
(6)使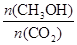 增大,改变条件使平衡向正反应移动即可。但只增大二氧化碳的浓度会使该比值减小,则A、升高温度,平衡向逆反应移动,
增大,改变条件使平衡向正反应移动即可。但只增大二氧化碳的浓度会使该比值减小,则A、升高温度,平衡向逆反应移动,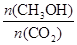 减小,故A错误;B、加入催化剂,平衡不移动,
减小,故A错误;B、加入催化剂,平衡不移动,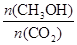 不变,故B错误;C、将H2O(g)从体系中分离,平衡向正反应移动,
不变,故B错误;C、将H2O(g)从体系中分离,平衡向正反应移动,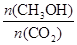 增大,故C正确;D、充入He(g),压强增大,但反应混合物的浓度不变,平衡不移动,
增大,故C正确;D、充入He(g),压强增大,但反应混合物的浓度不变,平衡不移动,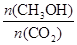 不变,故D错误;答案选C。
不变,故D错误;答案选C。
考点:考查热化学方程式的书写、外界条件对平衡状态和平衡常数的影响、反应速率的计算等


科目:高中化学 来源: 题型:填空题
化学反应过程中发生物质变化的同时,常常伴有能量的变化。这种能量的变化常以热量的形式表现出来,叫做反应热。由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等。
(1)下列 △ H 表示物质燃烧热的是 (填字母编号)。
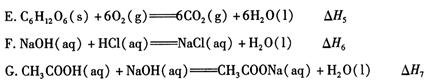
(2)依据上述热化学方程式,稀硝酸与氢氧化钾溶液发生中和反应的热化学方程式为 (其中热效应从上述 △H1 ~△H7尽中选取)。
(3)中和热的测定是高中化学的定量实验之一。 50 mL0.50 mol/L 盐酸与 50 mL 0.55 mol/L NaOH 溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。从实验装置上看,图中尚缺少的一种仪器是。大烧杯上如不盖硬纸板,求得的中和热数值将会(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。
(1)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下: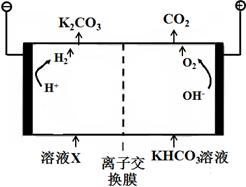
在阳极区发生的反应包括 和H ++ HCO3-=H2O+CO2↑。
简述CO32-在阴极区再生的原理 。
(2)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。
已知:25 ℃,101 KPa下:
H2(g)+1/2 O2(g)=H2O(g) Δ H1=" -242" kJ/mol
CH3OH(g)+3/2 O2(g)=CO2 (g)+2 H2O(g) Δ H2=" -676" kJ/mol
写出CO2和H2生成气态甲醇等产物的热化学方程式 。
下面表示合成甲醇的反应的能量变化示意图,其中正确的是 (填字母序号)。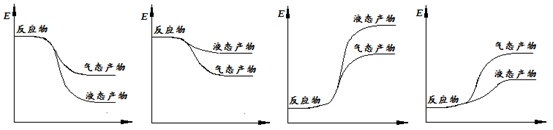
a b c d
(3)微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置。已知某种甲醇
微生物燃料电池中,电解质溶液为酸性,示意图如下: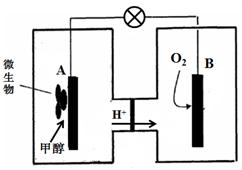
该电池外电路电子的流动方向为 (填写“从A到B”或“从B到A”)。
工作结束后,B电极室溶液的pH与工作前相比将 (填写“增大”、“减小”或“不变”,溶液体积变化忽略不计)。
A电极附近甲醇发生的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
100℃时,在1L恒温恒容的密闭容器中,通入0.1 mol N2O4,发生反应:N2O4(g)  2NO2(g);△H=" +57.0" kJ·mol-1,NO2和N2O4的浓度如图甲所示。NO2和N2O4的消耗速率与其浓度的关系如乙图所示,
2NO2(g);△H=" +57.0" kJ·mol-1,NO2和N2O4的浓度如图甲所示。NO2和N2O4的消耗速率与其浓度的关系如乙图所示,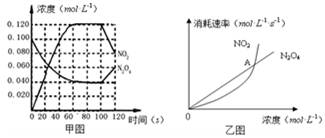
(1)在0~60s内,以N2O4表示的平均反应速率为 mol·L-1·s-1。
(2)根据甲图中有关数据,计算100℃时该反应的平衡常数K1= =0.36mol.L-1.S-1
若其他条件不变,升高温度至120℃,达到新平衡的常数是k2,则k1 k2(填“>”、“<”或“=”)。(3)反应进行到100s时,若有一项条件发生变化,变化的条件可能是 。
A.降低温度 B.通入氦气使其压强增大 C.又往容器中充入N2O4 D.增加容器体积
(4)乙图中, 交点A表示该反应的所处的状态为 。
A.平衡状态 B.朝正反应方向移动 C.朝逆反应方向移动 D.无法判断
(5)已知N2(g)+2O2(g)=2NO2(g) △H=" +67.2" kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=" -534.7" kJ·mol-1
N2O4(g)  2NO2(g) △H=" +57.0" kJ·mol-1
2NO2(g) △H=" +57.0" kJ·mol-1
则2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H= kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
臭氧可用于净化空气、饮用水消毒、处理工业废物和作为漂白剂。
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)= 3Ag2O(s); △H=-236kJ·mol-1,
已知:2Ag2O(s)= 4Ag(s)+O2(g); △H=" +62" kJ·mol-1,
则O3转化为O2的热化学方程式为________________________________________________。
(2)臭氧在水中易分解,臭氧的浓度减少一半所需的时间如下表所示。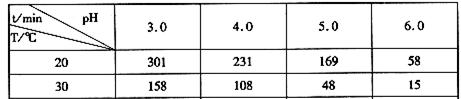
由上表可知pH增大能加速O3分解,表明对O3分解起催化作用的是__________(填微粒符号)。
(3)电解法臭氧发生器具有臭氧浓度高、成分纯净、在水中溶解度高的优势,在医疗、食品加工与养殖业及家庭方面具有广泛应用前景。科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。
臭氧在阳极周围的水中产生,其电极反应式为_______________________;阴极附近的氧气则生成过氧化氢,其电极反应式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分) 能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g)  CH3OH(g)
CH3OH(g)
反应II: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)
上述反应符合“原子经济”原则的是 (填“I”或“Ⅱ”)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH =-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH =-44.0 kJ/mol
则CH3OH(l)+ O2(g) = CO(g) + 2H2O(l) ΔH=
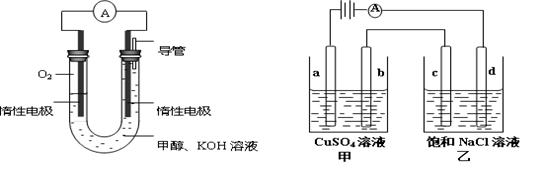
(3)某实验小组依据甲醇燃烧的反应原理,设计如下左图所示的电池装置。
① 该电池负极的电极反应为 。
② 工作一段时间后,测得溶液的pH (填增大、不变、减小)。
③用该电池作电源,组成如下右图所示装置(a、b、c、d均为石墨电极),甲容器装250mL0.04mol/LCuSO4溶液,乙容器装300mL饱和NaCl溶液,写出c电极的电极反应 ,常温下,当300mL乙溶液的pH为13时,断开电源,则在甲醇电池中消耗O2的体积为 mL(标准状况) ,电解后向甲中加入适量下列某一种物质,可以使溶液恢复到原来状态,该物质是 (填写编号) 。
| A.CuO | B.CuCO3 | C.Cu(OH)2 | D.Cu2(OH)2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)在298K时,1molCH4在氧气中完全燃烧生成二氧化碳和液态水,放出热量890.0 kJ。写出该反应的热化学方程式 。现有CH4和CO的混合气体0.75mol,完全燃烧后,生成CO2气体和18克液态水,并放出515kJ热量,则CH4和CO的物质的量分别为 、 mol.
(2)利用该反应设计一个燃料电池:用氢氧化钾溶液作电解质溶液,多孔石墨做电极,在电极上分别通入甲烷和氧气。通入甲烷气体的电极应为 极(填写“正”或“负”),该电极上发生的电极反应是 (填字母代号)。
a. CH4—e- + 2O2 ="=" CO2 + 2H2O
b. CH4—8e- + 10OH- ="=" CO32- + 7H2O
c. O2 + 2H2O + 4 e- ="=" 4OH-
d. O2—4 e- + 4H+ ="=" 2H2O
(3)在如图所示实验装置中,石墨棒上的电极反应式为 ;如果起始时盛有1000mL pH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时可观察到的现象是 ;若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入 (填物质名称),其质量约为 。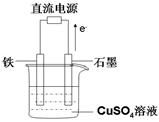
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
到目前为止,由化学能转变为热能或电能仍然是人类使用最主要的能源。
(1)化学反应中放出的热能(焓变,ΔH)与反应物和生成物的键能(E)有关。
已知:H2(g)+Cl2(g)=2HCl(g) ΔH=-185kJ/mol
E(H-H)=436 kJ/mol,E(Cl-Cl)=247 kJ/mol
则E(H-Cl)= ;
(2)已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-25kJ/mol
3 Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH=-47kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+19kJ/mol
请写出CO还原FeO的热化学方程式: ;
最近,又有科学家制造出一种使用固体电解质的燃料电池,其效率更高。一个电极通入空气,另一个电极通入汽油蒸汽。其中固体电解质是掺杂了Y2O3(Y:钇)的ZrO2(Zr:锆) 固体,它在高温下能传导O2-离子(其中氧化反应发生完全)。以丁烷(C4H10)代表汽油。
①电池的正极反应式为 ____ ;
②放电时固体电解质里的O2-离子的移动方向是向 极移动(填正或负)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
研究NO2、SO2 、CO等大气污染气体的测量及处理具有重要意义。
(1)I2O5可使H2S、CO、HC1等氧化,常用于定量测定CO的含量。已知:
2I2(s)+5O2(g)=2I2O5(s) △H=-75.56 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ·mol-1
写出CO(g)与I2O5(s)反应生成I2(s)和CO2(g)的热化学方程式: 。
(2)一定条件下,NO2与SO2反应生成SO3和NO两种气体:NO2(g)+SO2(g) SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1molSO2的同时生成1molNO
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K= 。
(3)从脱硝、脱硫后的烟气中获取二氧化碳,用二氧化碳合成甲醇是碳减排的新方向。将CO2转化为甲醇的热化学方程式为:CO2 (g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
①取五份等体体积CO2和H2的的混合气体 (物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如图所示,则上述CO2转化为甲醇反应的△H3 0(填“>”、“<”或“=”)。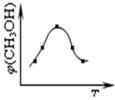
②在容积为1L的恒温密闭容器中充入1molCO2和3molH2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如下左图所示。若在上述平衡体系中再充0.5molCO2和1.5mol水蒸气(保持温度不变),则此平衡将 移动(填“向正反应方向”、“不”或“逆反应方向”)。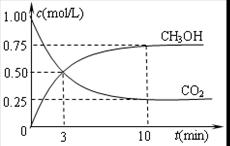
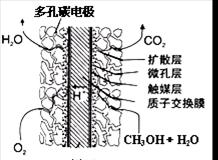
③直接甲醇燃料电池结构如上右图所示。其工作时负极电极反应式可表示为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com