
【题目】如下图所示A是固体金属单质,燃烧时火焰呈黄色。

(1)写出下列转化的化学方程式。
A→B________________;
B→C___________。
(2)列举下列物质的一种主要用途:
A_____________;
B_________________。
(3)在上述物质转化关系图中的化学反应里,没有元素化合价变化的是______(用“A→B”这样的形式表示)。
【答案】2Na+O2![]() Na2O2 2Na2O2+2H2O=4NaOH+O2↑ 用于钛、锆、铌、钽等金属的冶炼 用于呼吸面具里的供氧剂 C→D
Na2O2 2Na2O2+2H2O=4NaOH+O2↑ 用于钛、锆、铌、钽等金属的冶炼 用于呼吸面具里的供氧剂 C→D
【解析】
如图所示A是固体金属单质,燃烧时火焰呈黄色,则A为Na,B为Na2O2,C为NaOH,D为Na2CO3,据此分析解答。
金属单质A燃烧时火焰呈黄色,则A为Na,B为Na2O2,C为NaOH,D为Na2CO3。
(1)A→B的反应为钠点燃反应生成过氧化钠,反应的化学方程式为:2Na+O2![]() Na2O2;B→C的反应为过氧化钠和水反应生成氢氧化钠和氧气,反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na+O2
Na2O2;B→C的反应为过氧化钠和水反应生成氢氧化钠和氧气,反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na+O2![]() Na2O2;2Na2O2+2H2O=4NaOH+O2↑;
Na2O2;2Na2O2+2H2O=4NaOH+O2↑;
(2)A为Na,为活泼金属,可用于钛、锆、铌、钽等金属的冶炼;B为过氧化钠,可与水、二氧化碳反应生成氧气,可用于呼吸面具里的供氧剂,故答案为:用于钛、锆、铌、钽等金属的冶炼;用于呼吸面具里的供氧剂;
(3)没有元素化合价变化的是二氧化碳和氢氧化钠溶液的反应,是C→D,故答案为:C→D。


科目:高中化学 来源: 题型:
【题目】将一定量的由Cu和Cu2O组成的混合粉末加入到125 mL 2.6 mol·L-1的硝酸中,固体恰好完全溶解,得蓝色溶液X并收集到V mL(标准状况)的纯净无色气体Y。下列结论正确的是( )
A. X中有两种溶质
B. Y通入纯水中得到酸性溶液
C. 原混合粉末的总质量小于7.8 g
D. 当V=1 680时,原混合粉末中Cu和Cu2O的物质的量之比为8∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有研究人员设计了如下利用含硫物质热化学循环实现太阳能的转化与存储的过程.

回答下列问题:
(1)反应I中,主要能量转化形式为__________能转化为_____________能。
(2)S在元素周期表中位于第___________周期第_____________族。
(3)下列事实中,能说明硫的非金属性比碳强的是__________________(填标号)。
A.H2SO3的酸性比H2CO3的酸性强
B.在硫与碳的化合物CS2中S显负价
C.硫的单质的硬度比金刚石低
(4)配平反应Ⅱ的化学方程式:________SO2+_________H2O=______H2SO4+______S,该反应中氧化剂是_______________。
(5)通过反应Ⅲ也可以不经过热能转化过程而直接获取电能,化学上将实现这一直接转化的装置称为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似。气态时,已知断裂1mol N—N键吸收193kJ热量,断裂1mol N≡N键吸收941kJ热量,则( )
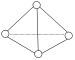
A. N4与N2互称为同位素 B. 1mol N4气体转化为N2时要吸收748kJ能量
C. N4是N2的同系物 D. 1mol N4气体转化为N2时要放出724kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 硅与氢氟酸的反应:Si+4H++4F-=SiF4↑+2H2↑
B. 向NaHCO3溶液中加入少量Ca(OH)2溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O
C. 向苯酚溶液中滴加Na2CO3溶液:2![]() +CO32-
+CO32-![]()
![]() +CO2↑+H2O
+CO2↑+H2O
D. 向氯化亚铁溶液中滴加稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在固定2L密闭容器中,充入X、Y各2 mol,发生可逆反应 X(g)+2Y(g) ![]() 2 Z(g),并达到平衡,以Y的浓度改变表示的反应速率v(正)、v(逆)与时间t的关系如图,
2 Z(g),并达到平衡,以Y的浓度改变表示的反应速率v(正)、v(逆)与时间t的关系如图,

则Y的平衡浓度(mol / L)表示式正确的是(式中S指对应区域的面积)
A、2 – S aob B、1 – Saob
C、2 – S abdo D、1 – S bod
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的分类如图所示:

由图判断下列说法中不正确的是( )
A.甲图所示的分类方法属于树状分类法
B.乙图所示的分类方法属于交叉分类法
C.碱性氧化物一定是金属氧化物
D.非金属氧化物一 定是酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:2SO2(g)+O2(g)![]() 2SO3(g),其正反应放热。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是( )
2SO3(g),其正反应放热。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是( )

A. 容器I、Ⅲ中平衡常数相同
B. 容器II、Ⅲ中正反应速率相同
C. 容器Ⅱ、Ⅲ中的反应达平衡时,SO3的体积分数:II 〈 III
D. 容器Ⅰ中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化锌是一种常用添加剂,广泛应用于塑料、合成橡胶、电池等产品的制造。一种利用氧化锌烟灰制备活性氧化锌的工艺流程如下:

已知:I.氧化锌烟灰的主要化学组成如下:
元素组成 | Zn | Pb | Cu | Cl | F |
质量分数% | 59.78 | 9.07 | 0.30 | 2.24 | 1.80 |
Ⅱ.浸出”时,大部分锌元素以Zn(NH3)42+形式进入溶液,同时部分Pb、Cu、F元素也进入溶液中。
(1)氨的电子式______________________。
(2)“浸出”时,氧化锌发生反应的离子方程式为_________________________________;“浸出”时温度不宜过高,其原因为____________________________________________。
(3)若“浸出”后,所得溶液中c(F-)=0.02mol/L,向其中加入等体积的氯化钙溶液(忽略溶液体积变化),使F-沉淀完全即溶液中c(F-)<10-5mol/L,则所加氯化钙溶液的浓度度最小为___________。已知:Ksp(CaF2)=3.45×10-11
(4)“置换”时,所得置换渣中除了含Zn外,还含有___________;“净化”时,利用活性炭___________性,除去溶液中残留的有机物。
(5)“沉淀”时,可得到滤渣Zn(NH3)2Cl2。所加盐酸过量时,会导致沉淀部分溶解甚至消失,其化学方程式为____________________________________________。
(6)“一次水解”时,产物为Zn(OH)xCly。取10.64g该水解产物,经二次水解、煅烧后,可得活性氧化锌8.1g(假设各步均转化完全)。则一次水解产物的化学式为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com