
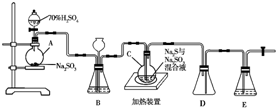
 工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如下装置(略去部分夹持仪器)模拟生产过程.烧瓶C中发生反应如下:
工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如下装置(略去部分夹持仪器)模拟生产过程.烧瓶C中发生反应如下:分析 (1)液柱高度保持不变,说明气密性良好;D中左侧为短导管,为安全瓶,防止倒吸;装置E起到吸收尾气中SO2、H2S的作用;
(2)根据题目所给3个反应,可得出对应关系:2Na2S~2H2S~3S~3 Na2SO3,2Na2S反应时同时生成2Na2SO3,还需要1Na2SO3;
(3)观察SO2的生成速率,发生强酸制取弱酸的反应,为使SO2缓慢进入烧瓶C,应控制B中硫酸的加入速度,Ⅲ中发生S(g)+Na2SO3(aq)$\frac{\underline{\;\;△\;\;}}{\;}$Na2S2O3(aq),反应达到终点是S完全溶解,烧杯、锥形瓶需要加热时必须使用石棉网,蒸发皿、试管可直接加热;
(4)加入盐酸,Na2S2O3反应生成S沉淀,所以静置后取上层清液,滴加BaCl2溶液,检验溶液中是否含有硫酸根离子.
解答 解:(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若液柱高度保持不变,则气密性良好;D中左侧为短导管,为安全瓶,防止倒吸;装置E起到吸收尾气中SO2、H2S的作用,可选用NaOH溶液,
故答案为:液柱高度保持不变;防止倒吸;NaOH;
(2)根C中Na2S和Na2SO3恰好完全反应,由Na2S(aq)+H2O(l)+SO2(g)═Na2SO3(aq)+H2S(aq)(Ⅰ)
2H2S(aq)+SO2(g)═3S(s)+2H2O(l)(Ⅱ)
S(g)+Na2SO3(aq)$\frac{\underline{\;\;△\;\;}}{\;}$Na2S2O3(aq)(Ⅲ)
可知,(Ⅰ)×2+(Ⅱ)+(Ⅲ)×3,得到总反应为2Na2S(aq)+Na2SO3(aq)+3SO2(g)$\frac{\underline{\;\;△\;\;}}{\;}$3Na2S2O3(aq),则C中Na2S和Na2SO3物质的量之比为2:1,
故答案为:2:1;
(3)观察SO2的生成速率,发生强酸制取弱酸的反应,a不生成二氧化硫,bd中物质均与二氧化硫反应,只有c中饱和NaHSO3溶液适合制取二氧化硫;为使SO2缓慢进入烧瓶C,应控制B中滴加硫酸的速度,Ⅲ中发生S(g)+Na2SO3(aq)$\frac{\underline{\;\;△\;\;}}{\;}$Na2S2O3(aq),反应达到终点是S完全溶解,可观察到溶液变澄清(或浑浊消失);烧杯、锥形瓶需要加热时必须使用石棉网,
故答案为:c;控制滴加硫酸的速度;溶液变澄清;ad;
(4)检测产品中是否存在Na2SO4的实验方案为:取少量产品溶于足量稀盐酸、静置、取上层清液(或过滤,取滤液)、滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质,
故答案为:取少量产品溶于足量稀盐酸、静置、取上层清液(或过滤,取滤液),滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质;
点评 本题考查实验方案的分析与评价,涉及气密性检验、离子检验、对操作的分析评价等,侧重实验分析能力及知识综合应用能力的考查,题目难度中等.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:解答题

 .
. .
. B.
B.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=5的NH4Cl溶液或醋酸溶液中,由水电离出的c(H+)均为10-9mol•L-1 | |
| B. | 常温下,将pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 | |
| C. | 在c(H+):c(OH-)=1:l012的溶液中,Na+、I-、NO3-、SO42-能大量共存 | |
| D. | 0.1 mol•L-1 Na2CO3溶液和0.1 mol•L-1 NaHSO4溶液等体积混合,溶液中:c(Na+)+c(H+)=c(CO32-)+c(SO42-)+c(HCO3-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.| 电负性 | 熔沸点 | 稳定性 | 酸性 |
| O>N | NH3>PH3 | Fe2+< Fe3+ | H3PO4<HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫通入氯化铁溶液:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+ | |
| B. | 硫酸氢铵溶液中滴加少量NaOH溶液:H++NH4++2OH-=NH3•H2O+H2O | |
| C. | 碱性条件下铝粉还原NaNO2:NO2-+2Al+3OH-+H2O=2AlO2-+NH3•H2O | |
| D. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3=FeO42-+3Cl-+H2O+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化钙和铁粉常用作食品干燥剂 | |
| B. | 二氧化硫有毒所以不能用作食品防腐剂 | |
| C. | 碳酸钡不溶于水因此在医疗上用作钡餐 | |
| D. | 当光束通过稀豆浆时能产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知Ka(HCN)<Ka(CH3COOH),当物质的量浓度相同时,CH3COOH中水电离出c(H+)大于HCN中水电离出的c(H+) | |
| B. | 由C(石墨)=C(金刚石)△H=+1.90 kJ•mol-1可知,金刚石比石墨稳定 | |
| C. | 向2.0 mL浓度均为0.1 mol•L-1 的KCl、KI混合溶液中滴加1~2滴0.01 mol•L-1 AgNO3 溶液,振荡,沉淀呈黄色,说明AgCl 的Ksp比AgI 的Ksp大 | |
| D. | 在101 kPa时,2 g H2 完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧热的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=-285.8 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com