
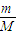 ,硫酸钡沉淀的物质的量为1mol,1mol硫酸钡只含有1mol的硫酸根部分,等体积的硫酸铝、硫酸锌、硫酸钠溶液,根据化学方程式,Al2(SO4)3只需要
,硫酸钡沉淀的物质的量为1mol,1mol硫酸钡只含有1mol的硫酸根部分,等体积的硫酸铝、硫酸锌、硫酸钠溶液,根据化学方程式,Al2(SO4)3只需要  mol/L,ZnSO4、Na2SO4均需要 1mol/L,根据电离方程式:
mol/L,ZnSO4、Na2SO4均需要 1mol/L,根据电离方程式: mol/LAl2(SO4)3,SO42-的物质的量浓度1mol/L,根据电离方程式:ZnSO4=Zn2++SO42- Na2SO4=2Na++SO42-,浓度均为1mol/LZnSO4、Na2SO4
mol/LAl2(SO4)3,SO42-的物质的量浓度1mol/L,根据电离方程式:ZnSO4=Zn2++SO42- Na2SO4=2Na++SO42-,浓度均为1mol/LZnSO4、Na2SO4 

科目:高中化学 来源: 题型:阅读理解
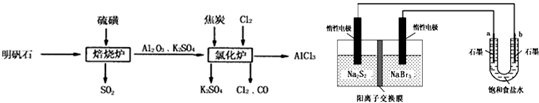
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式表达正确且为复分解反应的是
A.硫酸铵溶液中滴入氢氧化钡溶液:
![]()
B.硫代硫酸钠溶液中滴入稀硫酸:
![]()
C.等物质的量浓度的硫酸铝溶液与烧碱溶液按体积比1∶8混合:
![]()
D.将氯化铁溶液滴入氢硫酸中
2Fe3++3H2S====Fe2S3↓+6H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com