
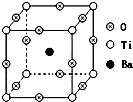
 如图所示为PTC元件(热敏电阻)的主要成分--钡钛矿晶体结构,该结构是具有代表性的最小重复单位.该晶体经X射线分析鉴定,重复单位为正方体,边长a=403.1pm,顶点位置为Ti4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占.
如图所示为PTC元件(热敏电阻)的主要成分--钡钛矿晶体结构,该结构是具有代表性的最小重复单位.该晶体经X射线分析鉴定,重复单位为正方体,边长a=403.1pm,顶点位置为Ti4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占.分析 (1)根据均摊法计算晶胞中Ti4+、Ba2+、O2-数目,确定比例关系书写化学式;
(2)根据晶胞结构可知,每个Ti4+周围有6个O2-,若Ti4+位于晶胞的体心,Ba2+位于晶胞的顶点,则O2-处于立方体面心上;
(3)由晶体结构,每个Ti4+周围与它最邻近且距离相等的Ti4+位于以为Ti4+交点棱上,补全晶胞可知,每个Ti4+周围有6个,形成正八面体结构;
(4)根据晶胞结构可知,每个Ti4+周围有6个O2-;
(5)根据Ba2+和O2-联合组成堆积在同一面上,Ba2+处于面的中心;
(6)根据ρ=$\frac{m}{V}$计算密度.
解答 解:(1)由结构可知,Ba2+位于体心有1个,Ti4+位于顶点,数目为8×$\frac{1}{8}$=1个,O2-位于棱心,数目为12×$\frac{1}{4}$=3个,故其化学式为BaTiO3;
故答案为:BaTiO3;
(2)根据晶胞结构可知,每个Ti4+周围有6个O2-,若Ti4+位于晶胞的体心,Ba2+位于晶胞的顶点,则O2-处于立方体面心上;
故答案为:面心;
(3)由晶体结构,每个Ti4+周围与它最邻近且距离相等的Ti4+位于以为Ti4+交点棱上,补全晶胞可知,每个Ti4+周围有6个,形成正八面体结构;
故答案为:6;正八面体;
(4)根据晶胞的结构可知,每个Ti4+周围有6个O2-,所以Ti4+的氧配位数为6;
故答案为:6;
(5)根据晶胞结构可知,每个Ti4+周围有6个O2-,若Ti4+位于晶胞的体心,Ba2+位于晶胞的顶点,则O2-处于立方体面心上;
故答案为:面心立方;
(6)Ba2+位于体心有1个,Ti4+位于顶点,数目为8×$\frac{1}{8}$=1个,O2-位于棱心,数目为12×$\frac{1}{4}$=3个,在每个晶胞中含有一个CaTiO3,质量为$\frac{136}{6.02×10{\;}^{23}}$g;晶体密度ρ=$\frac{m}{V}$=$\frac{{\frac{136}{6.02×10{\;}^{23}}g}^{\;}}{(403.1×1{0}^{-10}cm)^{3}}$g/cm3=3.45g/cm3;
故答案为:3.45g/cm3.
点评 本题考查核外电子排布、晶胞结构与计算,需要学生具有较好的空间想象力,晶胞中微粒配位数的解答可以结合化学式判断或利用晶胞补全法,难度中等.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,0.05 NA 个 CO2 分子所占体积为 1.12 L | |
| B. | 标准状况时,22.4 L CH4 和CO2 的混合气体所含分子数为 NA | |
| C. | 500 mL 0.2 mol•L-1CaCl2 溶液中 Cl- 离子总数为 0.2 NA | |
| D. | NA 个 H2O 分子的质量与 H2O 的摩尔质量在数值上相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,4-三甲基-3,3-二乙基己烷 | |
| B. | 3,3,5-甲基-4,4-二乙基己烷 | |
| C. | 3,3,-二甲基-3-乙基-3-异丙基己烷 | |
| D. | 2,4,4-三甲基-3,3-二乙基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18g重水含有10NA 个电子 | |
| B. | 室温下,42.0g乙烯和丙烯的混合气体中含有的碳原子数约为3 NA | |
| C. | 常温下0.05 mol•L-1Fe2(S04 ) 3溶液中含Fe 3+数目小于0.1NA | |
| D. | 用惰性电极电解饱和食盐水,当阴极得到2NA个电子时阳极产生22.4 L气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
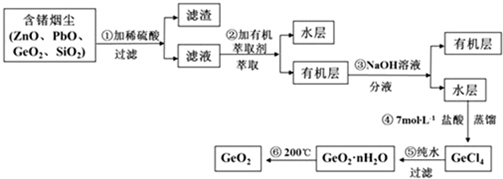
 (3)第④步加入盐酸作用中和NaOH,作反应物,抑制GeCl4水解(答两点即可).
(3)第④步加入盐酸作用中和NaOH,作反应物,抑制GeCl4水解(答两点即可).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2分子比例模型: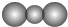 | |
| B. | 中子数为21的钾原子:4019K | |
| C. | NH4I的电子式: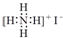 | |
| D. | HCO3-的电离方程式:HCO3-+H2O?H3O++CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com