
下列解释实验事实的化学方程式或离子方程式不正确的是
A.氯气用于自来水的杀菌消毒:Cl2+H2O HCl+HClO
HCl+HClO
B.将“NO2球”浸泡在热水中,颜色变深:2NO2(g)  N2O4(g)
N2O4(g)  H<0
H<0
C.向Ba(OH)2溶液中滴加NaHSO4溶液,至溶液呈中性:OH-+ Ba2++ H++SO42- = BaSO4↓+ H2O
D.铜片溶解在KNO3和稀硫酸的混合液中:3Cu + 8H+ + 2NO3- === 3Cu2+ + 2NO↑ + 4H2O
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源:2014-2015甘肃省高一上学期期末考试化学试卷(解析版) 题型:选择题
与铁相似,金属锡能与盐酸反应生成氯化亚锡(SnCl2),氯化亚锡又能被氯化铁氧化为氯化锡(SnCl4)。则下列有关粒子氧化性和还原性强弱的比较中,正确的是
A.氧化性:Sn4+<Sn2+ B.氧化性:Fe3+<Sn4+
C.还原性:Fe2+<Sn2+ D.还原性:Fe<Sn
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省郑州市高三第一次质量预测化学试卷(解析版) 题型:填空题
(10分)二氧化锰是化学工业中常用的氧化剂和有机合成中的催化剂,其主要制备方法是碳酸锰热分解,反应原理为2MnCO3+O2 2MnO2+2CO2。经研究发现该反应过程为①MnCO3
2MnO2+2CO2。经研究发现该反应过程为①MnCO3 MnO+CO2 ②2MnO+O2
MnO+CO2 ②2MnO+O2 2MnO2。
2MnO2。
回答下列问题:
(1)某温度下该平衡体系的压强为P,CO2、O2的物质的量分别为n1和n2,用平衡分压代替平衡浓度,写出碳酸锰热分解反应的平衡常数表达式K= (分压=总压×物质的量分数);K与反应①、②的平衡常数K1、K2关系为 。
(2)反应②在低温下能自发进行,则其△H 0(填“>”、“<”、“=”)。
(3)某科研小组对碳酸锰热分解法制二氧化锰的条件(焙烧温度和气氛)进行了研究,获得如下三幅图。该制备反应合适的焙烧温度为 ,合适的含水量气氛条件为 。
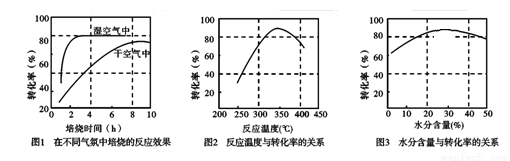
(4)MnO2也可在MnSO4—H2SO4—H2O为体系的电解液中电解获得,其阳极的电极反应式为 ,电解后溶液的pH将 (填“增大”、“ 减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省郑州市高三第一次质量预测化学试卷(解析版) 题型:选择题
X、Y、Z、M为原子序数依次增大的4种短周期元素。已知X、Y、Z是同周期的相邻元素,M原子的核外电子数是Z原子最外层电子数的2倍,Y与其同主族的短周期元素可形成一种常见的气体。下列说法正确的是
A.原子半径:M>X>Y>Z
B.对应氢化物的沸点:M>Z>Y>X
C.对应氢化物的稳定性:Z>X>Y>M
D.XY2与MY2溶于水都能得到对应的酸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省郑州市高三第一次质量预测化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.将纯水加热的过程中,Kw变大,pH变小
B.保存FeSO4溶液时,加入稀HNO3抑制Fe2+水解
C.FeCl3溶液蒸干、灼烧至恒重,最终得到FeCl3固体
D.向0.1 mol·L-1 氨水中加入少量水,pH减小, 减小
减小
查看答案和解析>>
科目:高中化学 来源:2014-2015学年贵州省七校联盟高三第一次联考理综化学试卷(解析版) 题型:实验题
(14分)
Ⅰ.实验室常用以下几种方法制取氯气
(1)二氧化锰与浓盐酸反应制氯气,写出其反应的离子方程式_________________________。
(2)高锰酸钾与浓盐酸反应制氯气,写出其反应的化学方程式_________________________。
(3)氯酸钾与浓盐酸反应制氯气,该反应中氧化产物与还原产物的物质的量之比为___________。
Ⅱ.某研究性学习小组利用下列装置制备漂白粉,并进行漂白粉有效成分的质量分数测定。

(1)装置④中的x试剂为_________________________;
(2)装置③中发生反应的化学方程式为___________________________________,该反应是放热反应,反应温度较高时有副反应发生,改进该实验装置以减少副反应发生的方法是____________________________;
(3)测定漂白粉有效成分的质量分数:称取1.000 g漂白粉于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.1000 mol·L-1 KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为:
3ClO-+ I-= 3Cl-+ IO3- IO3-+ 5I-+ 3H2O = 6OH-+ 3I2
实验测得数据如下表所示。
滴定次数 | 1 | 2 | 3 |
KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
该漂白粉中有效成分的质量分数为_______________;若滴定过程中未充分振荡溶液局部变浅蓝色时就停止滴定,则测定结果将_______________(填“偏高”、“偏低”或“无影响”) 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列叙述错误的是
①热稳定性:H2O>HF>H2S ②Fe是副族元素 ③IIA族元素的阳离子与上周期稀有气体元素的原子具有相同的核外电子排布 ④元素周期表中从IIIB到IIB族10个纵行的元素都是金属元素 ⑤多电子原子中,在离核较近的区域内运动的电子能量较高 ⑥已知H2SO4(aq)+2NaOH(aq)=2H2O(l)+Na2SO4(aq)△H=—114.6kJ/mol,则中和热为-57.3kJ·mol-1 ⑦两个非金属元素原子间只可能形成共价键,而含金属元素的化合物中一定含金属键
A、②④⑥ B、①⑤⑥ C、②③④ D、①②⑤⑦
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省福州市高三上学期期末考试化学试卷(解析版) 题型:选择题
下列物质中具有良好导电性的是
A.冰醋酸 B.盐酸 C.KCl晶体 D.蔗糖溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com