
| A. | FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| B. | Fe3O4 与稀硝酸反应:Fe3O4+8H+=2Fe3++Fe2++4H2O | |
| C. | 碳酸氢铵溶液与足量烧碱溶液共热:NH${\;}_{4}^{+}$+OH$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 将过量氨水中加入氯化铁溶液中:Fe3++3NH3•H2O═Fe(OH)3↓+3NH${\;}_{4}^{+}$ |
分析 A.氯气过量,溴离子、二价铁离子全部被氧化;
B.Fe3O4 与稀硝酸反应,反应生成硝酸铁和一氧化氮和水;
C.氢氧化钠过量,氨根离子、碳酸氢根离子都反应;
D.将过量氨水中加入氯化铁溶液中,反应生成氯化铵和氢氧化铁沉淀.
解答 解:A.氯气具有氧化性,能将亚铁离子和溴离子氧化,先氧化亚铁离子,通入足量的Cl2,此时Fe2+全部被氧化,溴离子也全部被氧化,此时离子方程式为:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,故A错误;
B.Fe3O4与稀硝酸反应的离子反应为3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O,故B错误;
C.碳酸氢铵与足量NaOH溶液混合反应生成碳酸钠和一水合氨,反应的离子方程式为:2OH-+NH4++HCO3-=CO32-+NH3•H2O+H2O,故C错误;
D.将过量氨水中加入氯化铁溶液中,离子方程式:Fe3++3NH3•H2O═Fe(OH)3↓+3NH4+,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意反应物用量对反应的影响,选项AC为易错选项.


科目:高中化学 来源: 题型:多选题
| 选项 | 操作及现象 | 溶液 |
| A | 缓慢通入反应C+2H2O+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4HCl生成的气体,变浑浊,继续通入,浑浊消失 | Ca(OH)2溶液 |
| B | 通入SO2和SO3混合气体,溶液变浑浊,无任何气体生成 | Ba(NO3)2溶液 |
| C | 通入SO2,溶液变浑浊,继续通SO2至过量,浑浊消失,再加入足量NaOH溶液,又变浑浊 | Ca(OH)2溶液 |
| D | 通入(NH4)2CO3受热分解产生的气体,变浑浊,继续通入,浑浊不消失 | Ca(OH)2溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
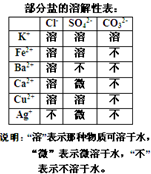 某混合物澄清透明的水溶液中,可能含有以下离子中若干种:K+、Ca2+、Fe2+、Cu2+、Cl-、CO32-、SO42-,现每次取该溶液100.00mL溶液进行以下实验:
某混合物澄清透明的水溶液中,可能含有以下离子中若干种:K+、Ca2+、Fe2+、Cu2+、Cl-、CO32-、SO42-,现每次取该溶液100.00mL溶液进行以下实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 六氟化氙(XeF6) | B. | 次氯酸(HClO) | C. | 三氟化硼(BF3) | D. | 二氧化氯(ClO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以根据PbI2和AgCl的Ksp的大小比较两者的溶解能力 | |
| B. | 常温下,同浓度的Na2S与NaHS溶液相比,NaHS溶液的pH大 | |
| C. | 能使碘化钾淀粉试纸变蓝的溶液中,Na+、S2-、Br-、NH4+等离子可以大量共存 | |
| D. | 等物质的量浓度的NH4Cl溶液和NH4HSO4溶液,后者的c(NH4+)大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、Cl-、SO42- | B. | NH4+、Na+、Cl-、CO32- | ||
| C. | K+、Na+、HCO3-、SO42- | D. | K+、Cu2+、H+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NO2(g)?N2O4 (g) | |
| B. | 2NO2(g)?2NO (g)+O2(g) | |
| C. | 2HI(g)?H2 (g)+I2(g) | |
| D. | FeCl3(aq)+3KSCN(aq)?Fe(SCN)3(aq)+3KCl(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 可逆反应:mA(g)+nB(s)?rC(g)+qD(g)在反应过程中,其它条件不变,D的百分含量和T或P关系如图,下列叙述中正确的是( )
可逆反应:mA(g)+nB(s)?rC(g)+qD(g)在反应过程中,其它条件不变,D的百分含量和T或P关系如图,下列叙述中正确的是( )| A. | 温度降低,化学平衡向逆方向移动 | |
| B. | 使用催化剂,D的物质的量分数增加 | |
| C. | 化学方程式系数m<r+q. | |
| D. | 物质B的颗粒越小,反应越快有利于平衡向正向中移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com