
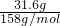 =0.2mol,由反应2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O可知,生成的氯气的物质的量为0.2mol×
=0.2mol,由反应2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O可知,生成的氯气的物质的量为0.2mol× =0.5mol,所以标准状况下,氯气的体积为0.5mol×22.4L/mol=11.2L,故答案为:11.2;
=0.5mol,所以标准状况下,氯气的体积为0.5mol×22.4L/mol=11.2L,故答案为:11.2; MnCl2+Cl2↑+2H2O可知,参加反应的HCl的物质的量为0.5mol×4=2mol,所以消耗HCl的质量为2mol×36.5g/mol=73g,
MnCl2+Cl2↑+2H2O可知,参加反应的HCl的物质的量为0.5mol×4=2mol,所以消耗HCl的质量为2mol×36.5g/mol=73g, MnCl2+Cl2↑+2H2O,根据方程式计算消耗盐酸.
MnCl2+Cl2↑+2H2O,根据方程式计算消耗盐酸.

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(19分)高锰酸钾是锰的重要化合物和常用的氧化剂。以下是实验室中模拟工业上用软锰矿制备高锰酸钾的流程图。
(1)操作Ⅰ的名称为 ;操作Ⅲ的名称为 。
(2)反应②的化学方程式为 。工业上用上述原理生产KMnO4方法产率较低,较好的制备方法是电解法。用Pt作阳极,Fe作阴极,K2MnO4为电解液,阳极的电极反应式为 。
(3)KMnO4是一种较稳定的化合物,但日光对KMnO4溶液的分解有催化作用,生成MnO2、KOH和O2。而MnO2也是该分解反应的一种催化剂,请你设计一个实验方案,验证MnO2对该分解反应具有催化性: 。
(4)KMnO4在酸性介质中的强氧化性广泛应用于分析化学中。
例如:2KMnO4+3H2SO4+5Na2SO35Na2SO4+K2SO4+2MnSO4+3H2O。某同学用KMnO4测定实验室长期存放的Na2SO3固体的纯度。现欲准确称取6.3 gNa2SO3固体样品,配成500 mL溶液。取25.00 mL上述溶液放入锥形瓶中,用0.01000 mol/L 的酸性KMnO4溶液进行滴定。滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 mL | 0.02 | 24.01 |
| 2 | 25.00 mL | 0.70 | 24.71 |
| 3 | 25.00 mL | 0.20 | 24.20 |
①配制500 mLNa2SO3溶液时,必须用到的实验仪器有:烧杯、玻璃棒、胶头滴管、药匙和 、 。
②判断滴定终点的依据是 。
③下列操作会导致测定结果偏高的是
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶未干燥
C.滴定前滴定管尖嘴部分有气泡
D.观察读数时,滴定前仰视,滴定后俯视
④用上述实验数据,计算Na2SO3的纯度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室也常用高锰酸钾(KMnO4)与浓盐酸反应制取氯气,反应的化学方程式如下: 2KMnO4 + 16HCl== 2KCl + 2MnCl2 +5Cl2 ↑+ 8H2O
(1) 此反的还原剂是: ,反应电子转移的数目为:
(2)反应中如果消耗31.6g KMnO4,则反应放出的氯气在标准状况下为 L
(3)如果用二氧化锰与浓盐酸制取等量的氯气,则消耗盐酸多少g?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com