
| A. | 氧化亚铁能与酸反应,可用于制作红色涂料 | |
| B. | 在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀 | |
| C. | 碘是人体必需的微量元素,所以要多吃富含高碘酸的食物 | |
| D. | 维生素C是水溶性维生素,能增强人体抵抗力,有解毒作用 |
分析 A.制作红色颜料的为氧化铁;
B.铜不如铁活泼,形成原电池反应时铁为负极;
C.碘是人体必须微量元素,每人每天大约吃食盐12克,多吃无益;
D.维生素C具有还原性,可用作抗败血酸.
解答 解:A.氧化亚铁为黑色,制作红色颜料的为氧化铁,故A错误;
B.铜不如铁活泼,形成原电池反应时铁为负极,加快铁的腐蚀,应用锌、镁等金属,故B错误;
C.碘是人体必需微量元素,所以要吃富含KIO3的食盐,但不能多吃,多吃会导致升高血压,促进动脉粥样硬化,故C错误;
D.维生素C易溶于水,具有还原性,可用作抗败血酸,增强人体抵抗力,有解毒作用,故D正确.
故选D.
点评 本题考查较为综合,侧重于化学与生活、生产的考查,有利于培养学生的良好的科学素养,提高学生学习的积极性,题目难度不大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | Na2SiO3溶液中滴加适量稀HCl制硅酸胶体:SiO32-+2H+═H2SiO3(胶体) | |
| B. | 用稀HNO3清洗试管壁上的银镜:3Ag+4H++NO3-═3Ag++NO↑+2H2O | |
| C. | (NH4)2SO4溶液与过量Ba(OH)2溶液混合:NH4++SO42-+Ba2++OH-═BaSO4↓+NH3•H2O | |
| D. | SO2通入氯水中:Cl2+SO2+2H2O═SO42-+2Cl-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检测时,电解质溶液中的H+向正极移动 | |
| B. | 若有 0.4 mol电子转移,则消耗 2.24 L氧气 | |
| C. | 正极上发生还原反应,负极上发生氧化反应 | |
| D. | 负极上的反应为:CH3CH2OH-4e-+H2O═CH3COOH+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
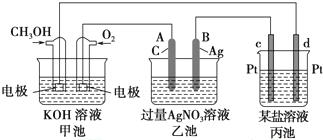
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 酸 | 醋酸 | 次氯酸 | 亚硝酸 |
| 电离常数(Ka) | 1.7×10-5 | 3.0×10-8 | 7.1×10-4 |
| A. | PH相同的氯水和亚硝酸溶液,水电离出的c(H+)相同 | |
| B. | 往氯水滴加NaOH溶液呈中性:c(Na+)=2(ClO-)+c(HClO) | |
| C. | 浓度相等的CH3COONa和NaNO2两份溶液中;c(CH3COO)->c(NO${\;}_{2}^{-}$) | |
| D. | 向pH=a的醋酸溶液中加一定量水,所得溶液的pH>a、pH<a、pH=a均有可能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
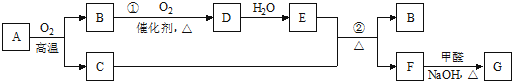
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | CH4 | CO2 | CO | H2 |
| 平衡浓度(mol•L-1) | 0.5 | 1.0 | 1.0 | 1.0 |
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
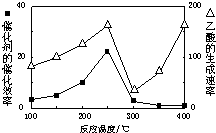
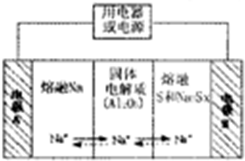
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com