
(1)在NaOH溶液中通入一定量的CO2后,溶液中溶质的组成可能是
①________ ,②________ ,③________ ,④_______ _。
(2)现有甲、乙两瓶无色溶液,已知它们可能为AlCl3溶液和NaOH溶液。现分别将一定体积的甲、乙两溶液混合,具体情况如下表所示,请回答:
实验① | 实验② | 实验③ | |
取甲瓶溶液的量 | 400 mL | 120 mL | 120 mL |
取乙瓶溶液的量 | 120 mL | 440 mL | 400 mL |
生成沉淀的量 | 1.56 g | 1.56 g | 3.12 g |
①甲瓶溶液为_______ _ 溶液。
②乙瓶溶液为________ 溶液,其物质的量浓度为________mol·L-1。
科目:高中化学 来源:2016届陕西省高三上学期期中化学试卷(解析版) 题型:选择题
取4.6 g铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生4480 mL的 NO2气体和336 mL的N2O4气体(都已折算到标准状况),在反应后的溶液中加入足量的氢氧化钠溶液,生成沉淀的质量为
A.9.02g B.8.26g C.8.51g D.7.04g
查看答案和解析>>
科目:高中化学 来源:2016届上海市十一校高三上学期12月联考化学试卷(解析版) 题型:选择题
下列各项中表达正确的是
A.H2O2的电子式: 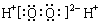
B.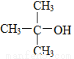 的命名:2,2—二甲基—2—乙醇
的命名:2,2—二甲基—2—乙醇
C.常温下,浓度都为0.1mol·Lˉ1的Na2CO3、NaHCO3溶液的pH,前者小于后者
D.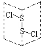 为二氯化二硫(S2Cl2)的结构,分子中有极性键、非极性键,是极性分子
为二氯化二硫(S2Cl2)的结构,分子中有极性键、非极性键,是极性分子
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一上学期12月月考化学试卷(解析版) 题型:选择题
取1mol/L的硫酸和盐酸各100mL,分别加入等质量的铁粉,反应后生成的气体质量比为3:2,则往硫酸中加入铁粉的质量为
A、2.8g B、4.2g C、8.4g D、11.2g
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二上学期12月月考化学试卷(解析版) 题型:选择题
常温下pH为2的盐酸,下列叙述正确的是
A.该溶液中盐酸电离出的c(H+)与水电离出的c(H+)之比为1010∶1
B.向该溶液中加入等体积pH为12的氨水恰好完全中和
C.将10 mL该溶液稀释至100 mL后,pH小于3
D.该溶液中由水电离出的c(H+)水×c(OH-)水=1×10-14
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一上学期12月月考化学试卷(解析版) 题型:选择题
把Ba(OH)2溶液滴入明矾溶液中,使SO42-全部转化成BaSO4沉淀,此时铝元素的主要存在形式是
A.Al3+ B.Al(OH)3 C.AlO2- D.Al3+和Al(OH)3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一上学期12月月考化学试卷(解析版) 题型:选择题
对于下列反应类型的判断,不正确的是
A.2FeCl2+Cl2====2FeCl3(化合反应)
B.3CO+Fe2O3 2Fe+3CO2(置换反应)
2Fe+3CO2(置换反应)
C.2KClO3 2KCl+3O2↑(氧化还原反应)
2KCl+3O2↑(氧化还原反应)
D.H2CO3 CO2↑+H2O(分解反应)
CO2↑+H2O(分解反应)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省桐乡市高二上期中(实验班)化学试卷(解析版) 题型:填空题
二甲醚是一种重要的化工原料,利用水煤气(CO、H2)合成二甲醚是工业上的常用方法,该方法由以下几步组成:
2H2(g)+CO(g)  CH3OH(g) ΔH= —90.0 kJ·mol-1 ①
CH3OH(g) ΔH= —90.0 kJ·mol-1 ①
2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH= —24.5 kJ·mol-1 ②
CH3OCH3(g)+H2O(g) ΔH= —24.5 kJ·mol-1 ②
CO(g)+H2O(g)  CO2(g)+H2(g) ΔH= —
CO2(g)+H2(g) ΔH= — 41.1 kJ·mol-1 ③
41.1 kJ·mol-1 ③
(1)反应①的ΔS 0(填“>”、“<”或“=”)。在 (填“较高”或“较低”)温度下该反应自发进行。
(2)在250℃的恒容密闭容器中,下列事实可以作为反应③已达平衡的是 (填选项字母)。
A.容器内气体密度保持不变 B.CO与CO2的物质的量之比保持不变
C.H2O与CO2的生成速率之比为1∶1 D.该反应的平衡常数保持不变
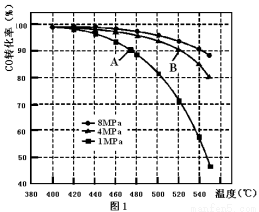
(3)当合成气中CO与H2的物质的量之比恒定时,温度、压强对CO转化率的影响如图1所示。图1中A点的v(逆) B点的v(正)(填“>”、“<”或“=”),说明理由 。实际工业生产中该合成反应的条件为500℃、4MPa请回答采用500℃的可能原因 。
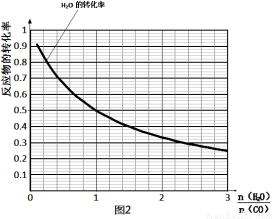
(4)一定温度下,密闭容器中发生反应③,水 蒸气的转化率与n(H2O)∕n(CO)的关系如图:计算该温度下反应③的平衡常数K= 。在图2中作出一氧化碳的转化率与n(H2O)∕n(CO)的曲线。
蒸气的转化率与n(H2O)∕n(CO)的关系如图:计算该温度下反应③的平衡常数K= 。在图2中作出一氧化碳的转化率与n(H2O)∕n(CO)的曲线。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二上期末考试化学试卷(解析版) 题型:填空题
甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g) △H1=﹣116kJ•mol﹣1
CH3OH(g) △H1=﹣116kJ•mol﹣1
(1)下列措施中有利于增大该反应的反应速率且利于反应正向进行的是___________。
a.随时将CH3OH与反应混合物分离 b.降低反应温度
c.增大体系压强 d.使用高效催化剂
(2)已知:CO(g)+ O2(g)═CO2(g) △H2=﹣283kJ•mol﹣1
O2(g)═CO2(g) △H2=﹣283kJ•mol﹣1
H2(g)+ O2(g)═H2O(g) △H3=﹣242kJ•mol﹣1
O2(g)═H2O(g) △H3=﹣242kJ•mol﹣1
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为________________________。
(3)在容积为2L的恒容容器中,分别研究在三种不同温度下合成甲醇,右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为2mol)与CO平衡转化率的关系.请回答:
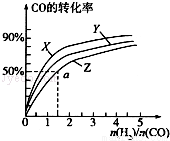
①在图中三条曲线,对应的温度由高到低的顺序是_________________。
②利用a点对应的数据,计算出曲线Z在对应温度下CH3OH(g) CO(g)+2H2(g)的平衡常数:K=_______________。
CO(g)+2H2(g)的平衡常数:K=_______________。
(4)恒温下,分别将1molCO和2molH2置于恒容容器I和恒压容器Ⅱ中(两容器起始容积相同),充分反应.
①达到平衡所需时间是I_________Ⅱ(填“>”、“<”或“=”,下同).达到平衡后,两容器中CH3OH的体积分数关系是I________Ⅱ。
②平衡时,测得容器I中的压强减小了30%,则该容器中CO的转化率为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com