
【题目】室温下,将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2,CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s)![]() CuSO4(s)+5H2O(1),热效应为ΔH3。则下列判断正确的是( )
CuSO4(s)+5H2O(1),热效应为ΔH3。则下列判断正确的是( )
A.ΔH1 =ΔH2 +ΔH3B.ΔH2>ΔH3
C.ΔH1+ΔH2=ΔH3D.ΔH1>ΔH3
【答案】A
【解析】
胆矾溶于水时,溶液温度降低,反应为CuSO45H2O(s)=Cu2+(aq)+SO42-(aq)+5H2O(l) △H1>0;
CuSO4(s)=Cu2+(aq)+SO42-(aq) △H2<0;分解反应为吸热反应,则CuSO45H2O(s)=CuSO4(s)+5H2O(l) △H3,根据盖斯定律确定ΔH1、ΔH2 、ΔH3之间的关系。
①胆矾溶于水时,溶液温度降低,反应CuSO45H2O(s)=Cu2+(aq)+SO42(aq)+5H2O(l) △H1>0;
②CuSO4(s)=Cu2+(aq)+SO42(aq) △H2<0;③已知CuSO45H2O(s)=CuSO4(s)+5H2O(l) △H3;
依据盖斯定律①②得到③,所以△H3=△H1△H2;△H2<0,△H1>0,则△H3>0,
A. ΔH1 =ΔH2 +ΔH3,A项正确;
B. 由上述分析可知,△H2<△H3,B项错误;
C. △H2<0、△H1>0、△H3=△H1△H2,则△H3>△H1+△H2,C项错误;
D. 分析可知△H2=△H1△H3,由于△H2<0,△H3>△H1,D项错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行如下反应2SO2(g)+O2(g)![]() 2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol·L-1、0.1mol·L-1、0.2mol·L-1,当反应至正、逆反应速率相等时,可能存在的数据是( )
2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol·L-1、0.1mol·L-1、0.2mol·L-1,当反应至正、逆反应速率相等时,可能存在的数据是( )
A.SO2为0.4mol·L-1、O2为0.2mol·L-1B.SO2为0.25mol·L-1
C.SO2、SO3均为0.15mol·L-1D.SO3为0.4mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)![]() CH3OH(g) △H<0,在容积为1 L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法不正确的是( )
CH3OH(g) △H<0,在容积为1 L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法不正确的是( )
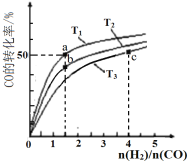
A. H2转化率:a>b>c
B. 上述三种温度之间关系为T1>T2>T3
C. a点状态下再通入0.5 mol CO和0.5 molCH3OH,平衡不移动
D. c点状态下再通入1 molCO和4 mol H2,新平衡中H2的体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是
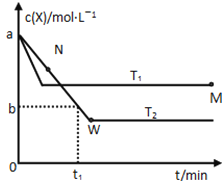
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0~t1时间内,υ(Y)=![]() mol/(L·min)
mol/(L·min)
C.M点的正反应速率υ正大于N点的逆反应速率υ逆
D.M点时再加入一定量的X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 在KI溶液中存在平衡:
在KI溶液中存在平衡:![]() ,某
,某![]() 、KI混合溶液中,
、KI混合溶液中,![]() 与温度T的平衡曲线图如图。下列说法不正确的是( )
与温度T的平衡曲线图如图。下列说法不正确的是( )

A.反应![]() 的
的![]()
B.若温度为![]() 、
、![]() ,反应的平衡常数分别为
,反应的平衡常数分别为![]() 、
、![]() ,则
,则![]()
C.若反应进行到状态D时,一定有![]()
D.状态A与状态B相比,状态A的![]() 小
小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中,正确的是
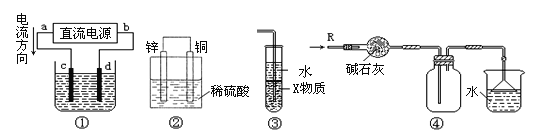
A. 若采用装置①精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
B. 装置②是原电池,能将化学能转化为电能,锌电极发生还原反应
C. 装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D. 装置④可用于收集氨气,并吸收多余的氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置的相关描述不正确的是
A.![]() 可用于叶绿体中色素的分离
可用于叶绿体中色素的分离
B.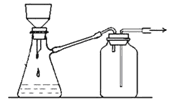 可用于过滤颗粒很小的沉淀,不宜于过滤胶状沉淀
可用于过滤颗粒很小的沉淀,不宜于过滤胶状沉淀
C. 可用于某些化学反应速率的测定。该装置气密性的检查如下:仪器组装好后,关闭分液漏斗活塞,将针筒活塞向外拉一段距离,然后松手,观察针筒是否能回到原来刻度处
可用于某些化学反应速率的测定。该装置气密性的检查如下:仪器组装好后,关闭分液漏斗活塞,将针筒活塞向外拉一段距离,然后松手,观察针筒是否能回到原来刻度处
D. 不可用来模拟氯碱工业
不可用来模拟氯碱工业
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示。下列说法正确的是

A. H2O2分解属于吸热反应
B. 加入催化剂,减小了反应的热效应
C. 加入催化剂,可提高正反应的活化能
D. 反应物的总能量高于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡 CH3COOH![]() CH3COO- + H+,下列叙述不正确的是
CH3COO- + H+,下列叙述不正确的是
A.升高温度,平衡正向移动,醋酸的电离常数Ka增大
B.CH3COOH溶液加少量的CH3COONa固体,平衡逆向移动
C.室温下,欲使0.1 mol/L醋酸溶液的电离度α增大,可加入少量冰醋酸
D.0.10 mol/L的CH3COOH 溶液加水稀释,溶液中c(CH3COOH)/c(CH3COO-)减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com