
| A. | 由于石墨和金刚石属于不同的单质,所以△H1和△H2不等 | |
| B. | 由于燃烧反应放热,所以△H1和△H2均取正值 | |
| C. | 由于石墨和金刚石同为碳元素组成,所以△H1=△H2 | |
| D. | 由于燃烧均为放热反应,所以石墨为重要的能源 |
分析 金刚石和石墨是碳元素的两种同素异形体,具有广泛的用途,是不同的两种碳单质,所含能量不同,燃烧放热不同,据此解答.
解答 解:A、金刚石和石墨是碳元素的两种同素异形体,是不同的两种碳单质,所含能量不同,故燃烧热△H1和△H2不等,故A正确;
B、燃烧是放热反应,故燃烧热△H<0,均为负值,故B错误;
C、金刚石和石墨是碳元素的两种同素异形体,是不同的两种碳单质,所含能量不同,故燃烧热△H1和△H2不等,故C错误;
D、石墨用途广泛,是主要的资源,做燃料是对资源的重大浪费,故D错误;
故选A.
点评 本题考查了金刚石和石墨所含能量不同的关系问题,注意同素异形体是不同的单质,所含能量不同.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 石英、水晶、玛瑙的主要成分都是单质硅 | |
| B. | 硅相对于氢气便于运输、贮存,从安全角度考虑,硅是有开发价值的燃料 | |
| C. | 实验室存放氢氧化钠溶液的试剂瓶应用细口玻璃瓶并配磨口玻璃塞 | |
| D. | 二氧化硅是一种良好的半导体材料,也是制造光导纤维的一种基本原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | X | Y | Z |
| 单质是淡黄色固体 | 与W同周期,其单质常用作半导体材料 | 原子最外层电子数是电子总数的$\frac{2}{3}$ | 第三周期原子半径最小的金属元素 |
| A. | 气态氢化物的热稳定性:X>W | |
| B. | 最高价氧化物对应水化物的酸性:Y>X | |
| C. | 简单离子半径:Z>W | |
| D. | 工业上用Y单质还原Z的氧化物得Z的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用稀AgNO3溶液洗涤AgCl沉淀比用水洗涤损耗AgCl小 | |
| B. | 对于Al(OH)3(s)?Al(OH)3(aq)?Al3++3OH-,前者为溶解平衡,后者为电离平衡 | |
| C. | 已知AgCl的 KSP=1.8×10-10,将AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) | |
| D. | 将KI溶液加入到AgCl的饱和溶液中,产生黄色沉淀,说明AgCl溶解度大于AgI |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
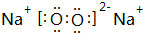 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
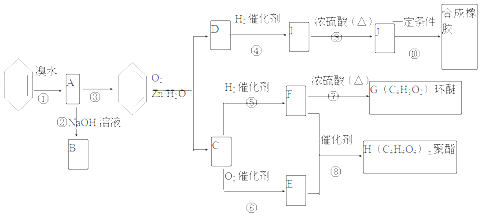
 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$ +2NaBr.C与足量银氨溶液反应的化学方程式OHC-CHO+4[Ag(NH3)2]OH
+2NaBr.C与足量银氨溶液反应的化学方程式OHC-CHO+4[Ag(NH3)2]OH H4NOOCCOONH4+4Ag↓+6NH3+2H2O
H4NOOCCOONH4+4Ag↓+6NH3+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种 | |
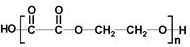
| B. | 与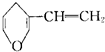 互为同分异构体的芳香族化合物有6种 互为同分异构体的芳香族化合物有6种 | |
| C. | 含有5个碳原子的某饱和链烃,其一氯取代物可能有3种 | |
| D. | 菲的结构简式为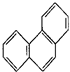 ,它与硝酸反应,可生成5种一硝基取代物 ,它与硝酸反应,可生成5种一硝基取代物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com