

 ),它能与Fe2+形成红色配合物(如图3),该配离子中Fe2+配位数为
),它能与Fe2+形成红色配合物(如图3),该配离子中Fe2+配位数为| 1 |
| 2 |
| 1 |
| 8 |
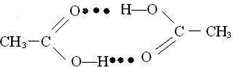 ,
,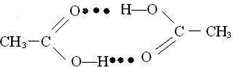 ;
;

科目:高中化学 来源: 题型:
 由徐光宪院士发起,院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星.
由徐光宪院士发起,院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星.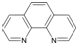 ),它能与Fe2+形成红色混合物(如图2),该配离子中Fe2+与氮原子形成配位键共有
),它能与Fe2+形成红色混合物(如图2),该配离子中Fe2+与氮原子形成配位键共有查看答案和解析>>
科目:高中化学 来源:江苏省盐城市2010届高三第二次调研考试化学试题 题型:022
由徐光宪院士发起,院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星.
(1)下列说法正确的是________.
(a)BF3和NH3都是含有极性键的非极性分子
(b)CO2、HCN分子中都含有两个σ键和两个π键
(c)H2S、O3分子都是直线形
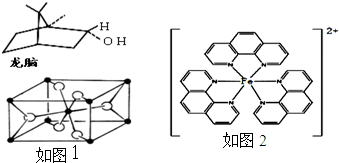
(d)一种双环单萜龙脑(如图)分子中有4个手性碳原子

(2)NO是人体中的信号分子,有关说法正确的________.
(a)第一电离能N大于O
(b)电负性O大于N
(c)NO+的结构为:N≡O+
(d)N、O元素在周期表中都处于p区
(3)TiO2的天然晶体中,最稳定的一种晶体结构如图,白球表示:________原子.

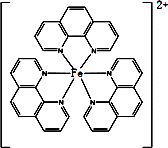
(4)二茂铁(C5H5)2Fe是Fe2+与环戊二烯基形成的一类配合物,其中Fe2+在基态时核外电子排布式为:________;实验室测定铁的含量可用配位剂邻二氮菲(![]() ),它能与Fe2+形成红色配合物(如图),该配离子中Fe2+配位数为________.
),它能与Fe2+形成红色配合物(如图),该配离子中Fe2+配位数为________.
(5)乙酸熔沸点很高,是由于存在以分子间氢键缔合的二聚体(含一个环状结构),请画出这二聚体的结构:________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com